Ozon

| |||
|
| |||
| İsimler | |||
|---|---|---|---|
| IUPAC adı
Ozon
| |||
| Sistematik IUPAC adı
Trioksijen | |||
| Diğer isimler
2λ4-trioksidien; katena-trioksijen
| |||
| Tanımlayıcılar | |||
CAS Numarası
|
|||
3D model (JSmol)
|
|||
| ChEBI | |||
| ChemSpider | |||
| EC Numarası |
| ||
Gmelin Referans
|
1101 | ||
IUPHAR/BPS
|
|||
| MeSH | Ozon | ||
PubChem CID
|
|||
| RTECS numarası |
| ||
| UNII | |||
InChI
| |||
GÜLÜMSEMELER
| |||
| Özellikler | |||
Kimyasal formül
|
O3 | ||
| Molar kütle | 47,997 g-mol-1 | ||
| Görünüş | Renksiz ila soluk mavi gaz | ||
| Koku | Keskin | ||
| Yoğunluk | 2,144 mg cm-3 (0 °C'de) | ||
| Erime noktası | -192,2 °C; -313,9 °F; 81,0 K | ||
| Kaynama noktası | -112 °C; -170 °F; 161 K | ||
Suda çözünürlük
|
1,05 g L-1 (0 °C'de) | ||
| Diğer çözücülerde çözünürlük | CCl4, sülfürik asit içinde çok çözünür | ||
| Buhar basıncı | 55,7 atm (-12,15 °C veya 10,13 °F veya 261,00 K) | ||
Manyetik duyarlılık (χ)
|
+6,7-10-6 cm3/mol | ||
Kırılma indisi (nD)
|
1.2226 (sıvı), 1.00052 (gaz, STP, 546 nm-yüksek dağılıma dikkat edin) | ||
| Yapı | |||
Uzay grubu
|
C2v | ||
Koordinasyon geometrisi
|
Digonal | ||
Moleküler şekil
|
Dihedral | ||
| Hibridizasyon | O1 için sp2 | ||
Dipol moment
|
0.53 D | ||
| Termokimya | |||
Std molar
entropi (S |
238,92 J K-1 mol-1 | ||
Std entalpi
oluşumu (ΔfH⦵298) |
142,67 kJ mol-1 | ||
| Tehlikeler | |||
| GHS etiketlemesi: | |||
Piktogramlar
|
    
| ||
Sinyal kelimesi
|
Tehlike | ||
Tehlike bildirimleri
|
H270, H314 | ||
| NFPA 704 (yangın elması) | |||
| Öldürücü doz veya konsantrasyon (LD, LC): | |||
LCLo (yayınlanan en düşük)
|
12,6 ppm (fare, 3 saat) 50 ppm (insan, 30 dakika) 36 ppm (tavşan, 3 saat) 21 ppm (fare, 3 saat) 21,8 ppm (sıçan, 3 saat) 24,8 ppm (kobay, 3 saat) 4,8 ppm (sıçan, 4 saat) | ||
| NIOSH (ABD sağlık maruziyet limitleri): | |||
PEL (İzin Verilebilir)
|
TWA 0,1 ppm (0,2 mg/m3) | ||
REL (Önerilen)
|
C 0,1 ppm (0,2 mg/m3) | ||
IDLH (Acil tehlike)
|
5 ppm | ||
| İlgili bileşikler | |||
İlgili bileşikler
|
Sülfür dioksit Trisülfür Disülfür monoksit Döngüsel ozon | ||
Aksi belirtilmedikçe, veriler standart durumdaki malzemeler için verilmiştir (25 °C [77 °F], 100 kPa'da).
Bilgi kutusu referansları
| |||
Ozon (/ˈoʊzoʊn/) veya trioksijen, O kimyasal formülüne sahip inorganik bir moleküldür
3. Belirgin keskin bir kokusu olan soluk mavi bir gazdır. İki atomlu O allotropundan çok daha az kararlı olan bir oksijen allotropudur.
2, alt atmosferde parçalanarak O
2 (dioksijen). Ozon, Dünya atmosferi içinde ultraviyole (UV) ışık ve elektriksel deşarjların etkisiyle dioksijenden oluşur. Güneş'in ultraviyole (UV) radyasyonunun çoğunu emen stratosferin ozon tabakasında en yüksek konsantrasyonda olmak üzere, atmosferin her yerinde çok düşük konsantrasyonlarda bulunur. ⓘ
Ozonun kokusu kloru andırır ve havada 0,1 ppm kadar düşük konsantrasyonlarda birçok insan tarafından tespit edilebilir. Ozonun O3 yapısı 1865 yılında belirlenmiştir. Molekülün daha sonra bükülmüş bir yapıya sahip olduğu ve zayıf diyamanyetik olduğu kanıtlanmıştır. Standart koşullarda ozon soluk mavi bir gazdır ve kriyojenik sıcaklıklarda yoğunlaşarak koyu mavi bir sıvıya ve son olarak da mor-siyah bir katıya dönüşür. Ozonun daha yaygın olan dioksijene göre kararsızlığı, hem konsantre gaz hem de sıvı ozonun yüksek sıcaklıklarda, fiziksel şokta veya kaynama noktasına kadar hızlı ısınmada patlayıcı bir şekilde ayrışabileceği şekildedir. Bu nedenle ticari olarak sadece düşük konsantrasyonlarda kullanılır. ⓘ
Ozon güçlü bir oksidandır (dioksijenden çok daha fazla) ve oksidasyonla ilgili birçok endüstriyel ve tüketici uygulamasına sahiptir. Ancak aynı yüksek oksitleme potansiyeli, ozonun hayvanlarda mukoza ve solunum dokularına ve ayrıca yaklaşık 0,1 ppm'lik konsantrasyonların üzerinde bitkilerdeki dokulara zarar vermesine neden olur. Bu durum ozonu yer seviyesine yakın yerlerde güçlü bir solunum tehlikesi ve kirletici haline getirirken, ozon tabakasındaki daha yüksek konsantrasyon (iki ila sekiz ppm) faydalıdır ve zararlı UV ışığının Dünya yüzeyine ulaşmasını engeller. ⓘ
Ozon gazı (O3), 3 oksijen atomundan oluşan molekülleriyle renksiz bir gazdır ve atmosferin üst katmanlarında yer alır. ⓘ
Oksijenin allotropudur, trioksijen olarak da tanımlanır. Normal koşullarda atmosferin alt kısımlarında O3 miktarı yaklaşık 0,04 ppm değerindedir. Bununla birlikte dumanlı sisin olduğu yerlerde ozon miktarı artmaktadır. Ozon'un 0,12 düzeyini aşması sağlığa zararlı kabul edilir. Ozon, gökyüzünün mavi renginin ana sebebidir. Sıvı hâlde lacivert renge dönüşen ozon gazı, Dünya'yı Güneş'ten gelen zararlı morötesi radyasyonuna karşı korumaktadır. Atmosferin üst katmanlarında UV ışınları, alt katmanlarında yıldırım çakması sonucu oluşan elektrik akımının oksijeni parçalaması ile oluşan ozon, havanın temizlenmesinde çok önemli bir rol oynamaktadır. Ozon gelişmiş ülkelerde gıda tekstil lojistik sağlık sektörlerinde yaygın bir şekilde alternatifsiz dezenfektan olarak kullanılmaktadır. ⓘ
Ham maddesi oksijen olan ozon depolanamayan ve stoklama imkânı olmayan tek gazdır. Ozonun stoklanamamasının sebebi Ozon gazının, bulunduğu ortamın sıcaklığı ile doğru orantılı olarak zamanla ham maddesi olan oksijene dönüşmesidir. Derin cerrahi yaraların tedavisinde etkilidir ve sağlık sektöründe tedavi amaçlı olarak kullanılmaktadır. Bilinçsiz kullanımının başta akciğer olmak üzere insan sağlığına yan etkileri vardır. ⓘ
İsimlendirme
Önemsiz isim olan ozon, en yaygın kullanılan ve tercih edilen IUPAC ismidir. Geçerli IUPAC isimleri olan 2λ4-trioksidien ve katena-trioksijen sistematik isimleri, sırasıyla ikame edici ve eklemeli isimlendirmelere göre oluşturulmuştur. Ozon adı, Yunanca koku anlamına gelen ozein (ὄζειν) fiilinden türemiştir ve ozonun kendine özgü kokusuna atıfta bulunur. ⓘ
Uygun bağlamlarda ozon, iki hidrojen atomu çıkarılmış trioksidan olarak görülebilir ve bu nedenle trioksidaniliden, ikame isimlendirmeye göre sistematik bir isim olarak kullanılabilir. Varsayılan olarak, bu isimler ozon molekülünün radikalliğini dikkate almaz. Daha da spesifik bir bağlamda, bu aynı zamanda radikal olmayan singlet zemin durumunu da adlandırabilirken, diradikal durum trioksidanediyl olarak adlandırılır. ⓘ
Trioksidanediyl (veya ozonid), sistematik olmayan bir şekilde, sübstitüent grubuna (-OOO-) atıfta bulunmak için kullanılır. Yukarıda verilen ozonun bağlama özgü adı ile grubun adının karıştırılmaması için dikkatli olunmalıdır. ⓘ
Tarihçe


1785 yılında Hollandalı kimyager Martinus van Marum su üzerinde elektrik kıvılcımı deneyleri yaparken olağandışı bir koku fark etti ve bunu elektrik reaksiyonlarına bağlayarak aslında ozon yarattığının farkına varamadı. ⓘ
Yarım yüzyıl sonra Christian Friedrich Schönbein aynı keskin kokuyu fark etti ve bunu genellikle bir şimşek çakmasının ardından gelen koku olarak tanıdı. 1839'da gaz halindeki kimyasalı izole etmeyi başardı ve Yunanca "koklamak" anlamına gelen ozein (ὄζειν) kelimesinden gelen "ozon" adını verdi. Bu nedenle Schönbein genellikle ozonun keşfi ile anılır. Ozonun formülü olan O3, 1865 yılına kadar Jacques-Louis Soret tarafından belirlenmemiş ve 1867 yılında Schönbein tarafından doğrulanmıştır. ⓘ
Ozon, 19. yüzyılın ikinci yarısının büyük bir bölümünde ve 20. yüzyıla kadar doğa bilimciler ve sağlık arayanlar tarafından çevrenin sağlıklı bir bileşeni olarak kabul edildi. Beaumont, Kaliforniya'nın resmi sloganı "Beaumont: Kartpostallarda ve Ticaret Odası antetli kağıtlarında da görüldüğü gibi "Ozon Bölgesi". Açık havada çalışan doğa bilimciler, ozon içeriği nedeniyle yüksek rakımların genellikle faydalı olduğunu düşünüyorlardı. Hawaii'de çalışan doğa bilimci Henry Henshaw, "[Yüksek rakımlarda] [çalışmak için] gerekli enerjiyi sürdürmeye yetecek kadar ozon içeren oldukça farklı bir atmosfer var" diye yazmıştır. Ozon içeriğine inanıldığı için deniz kıyısındaki havanın sağlıklı olduğu düşünülüyordu. Bu inanca yol açan koku aslında halojenli deniz yosunu metabolitleri ve dimetil sülfürdür. ⓘ
Ozonun çekiciliğinin büyük bir kısmı, arındırıcı özellikleriyle çağrışım yapan "taze" kokusundan kaynaklanıyor gibi görünüyor. Bilim insanları zararlı etkilerine dikkat çekti. 1873'te James Dewar ve John Gray McKendrick, "yıkıcı bir etki gösteren" "ozonlanmış havaya" maruz kaldıktan sonra kurbağaların halsizleştiğini, kuşların nefes nefese kaldığını ve tavşanların kanında oksijen seviyesinin azaldığını belgeledi. Schönbein, ozonun solunması sonucunda göğüs ağrıları, mukoza zarlarında tahriş ve nefes almada zorluk meydana geldiğini ve küçük memelilerin öldüğünü bildirmiştir. 1911'de Leonard Hill ve Martin Flack, Proceedings of the Royal Society B'de ozonun sağlığa yararlı etkilerinin "sadece yineleme yoluyla yaygın inancın bir parçası haline geldiğini ve yine de iyi etkileri lehine kesin fizyolojik kanıtların şimdiye kadar neredeyse tamamen eksik olduğunu" belirtmiştir. Ozonun fizyolojik etkilerine ilişkin olarak şu ana kadar ulaşılan tek kesin bilgi, akciğerlerde tahrişe ve ödemlere neden olduğu ve herhangi bir süre boyunca nispeten güçlü konsantrasyonda solunduğunda ölüme yol açtığıdır." ⓘ
Birinci Dünya Savaşı sırasında ozon, Londra'daki Queen Alexandra Askeri Hastanesi'nde yaralar için olası bir dezenfektan olarak test edilmiştir. Gaz, 15 dakika kadar uzun bir süre boyunca doğrudan yaralara uygulandı. Bunun sonucunda hem bakteri hücreleri hem de insan dokusu zarar gördü. Antiseptiklerle irrigasyon gibi diğer sterilizasyon teknikleri tercih edilebilir bulunmuştur. ⓘ
1920'lere kadar, az miktarda oksozon, O
4, patlayıcı konsantre kimyasala analitik kimya tekniklerini uygulamanın zorluğu nedeniyle ozon örneklerinde de mevcuttu. 1923 yılında Georg-Maria Schwab (doktora tezi için Ernst Hermann Riesenfeld'in yanında çalışıyordu) ozonu başarılı bir şekilde katılaştıran ve oksozon hipotezini kesin olarak çürüten doğru analizleri gerçekleştiren ilk kişi oldu. Saf konsantre ozonun şimdiye kadar ölçülmemiş diğer fiziksel özellikleri 1920'lerde Riesenfeld grubu tarafından belirlendi. ⓘ
Fiziksel özellikler
Ozon renksiz veya soluk mavi bir gazdır, suda az çözünür ve mavi bir çözelti oluşturduğu karbon tetraklorür veya florokarbonlar gibi polar olmayan inert çözücülerde çok daha fazla çözünür. 161 K'de (-112 °C; -170 °F) yoğunlaşarak koyu mavi bir sıvı oluşturur. Bu sıvının kaynama noktasına kadar ısınmasına izin vermek tehlikelidir, çünkü hem konsantre gaz ozon hem de sıvı ozon patlayabilir. 80 K (-193,2 °C; -315,7 °F) altındaki sıcaklıklarda mor-siyah bir katı oluşturur. ⓘ
Çoğu insan havada yaklaşık 0,01 μmol/mol ozon tespit edebilir; ozonun klorlu ağartıcıya benzeyen çok özel keskin bir kokusu vardır. 0,1 ila 1 μmol/mol maruziyet baş ağrısı, gözlerde yanma ve solunum yollarında tahrişe neden olur. Havadaki düşük ozon konsantrasyonları bile lateks, plastik ve hayvan akciğer dokusu gibi organik malzemeler için çok yıkıcıdır. ⓘ
Ozon zayıf diyamanyetiktir. ⓘ
Yapı
Mikrodalga spektroskopisinden elde edilen deneysel kanıtlara göre, ozon C2v simetrisine sahip (su molekülüne benzer) bükülmüş bir moleküldür. O - O mesafeleri 127,2 pm'dir (1,272 Å). O - O - O açısı 116,78°'dir. Merkezi atom bir yalnız çift ile sp² hibritleşmiştir. Ozon, dipol momenti 0,53 D olan polar bir moleküldür. Molekül, her biri bir tarafta tek bağ ve diğer tarafta çift bağ içeren iki katkıda bulunan yapıya sahip bir rezonans hibridi olarak temsil edilebilir. Düzenleme, her iki taraf için de 1,5'lik bir genel bağ düzenine sahiptir. Nitrit anyonu ile izoelektroniktir. Doğal olarak oluşan ozon, sübstitüe izotoplardan (16O, 17O, 18O) oluşabilir. Döngüsel bir form tahmin edilmiş ancak gözlemlenmemiştir. ⓘ

Tepkiler
Ozon bilinen en güçlü oksitleyici maddeler arasındadır ve O2'den çok daha güçlüdür. Aynı zamanda yüksek konsantrasyonlarda kararsızdır ve sıradan diyatomik oksijene dönüşür. Yarılanma ömrü sıcaklık, nem ve hava hareketi gibi atmosferik koşullara göre değişir. Laboratuvar koşullarında, Yarılanma Süresi (HLT) oda sıcaklığında (24 °C), saatte sıfır hava değişimi (ACH) ile sıfır nemde durgun havada ortalama ~1500 dakika (25 saat) olacaktır. Bu nedenle, saat başına hava değişiminin 5 ila 8 ACH arasında değiştiği tipik ofis veya ev ortamında, ozonun yarı ömrü otuz dakika kadar kısadır. ⓘ
- 2 O
3 → 3 O
2 ⓘ
Bu reaksiyon artan sıcaklıkla birlikte daha hızlı ilerler. Ozonun alev alması bir kıvılcımla tetiklenebilir ve ağırlıkça %10 veya daha yüksek ozon konsantrasyonlarında meydana gelebilir. ⓘ
Ozon ayrıca bir elektrokimyasal hücrenin anodundaki oksijenden de üretilebilir. Bu reaksiyon, araştırma amaçlı olarak daha küçük miktarlarda ozon oluşturabilir. ⓘ
- O
3(g) + 2H+ + 2e- ⇌ O
2(g) + H
2O E°= 2,075V ⓘ
Bu, voltaj gerekli voltajın üzerine ayarlandığında suyun elektrolizi sırasında bir Hoffman gaz aparatında istenmeyen bir reaksiyon olarak gözlemlenebilir. ⓘ
Metaller ile
Ozon çoğu metali (altın, platin ve iridyum hariç) en yüksek oksidasyon durumundaki metallerin oksitlerine oksitleyecektir. Örneğin:
- Cu + O
3 → CuO + O
2 ⓘ
- Ag + O
3 → AgO + O
2 ⓘ
Azot ve karbon bileşikleri ile
Ozon ayrıca nitrik oksidi azot dioksite okside eder:
- NO + O
3 → NO
2 + O
2
Bu reaksiyona kemilüminesans eşlik eder. NO
2 daha sonra nitrat radikaline oksitlenebilir:
- NO
2 + O
3 → NO
3 + O
2
NO
3 oluşan NO ile reaksiyona girebilir
2 oluşturmak için N
2O
5. ⓘ
Katı nitronyum perklorat NO2, ClO2 ve O'dan yapılabilir
3 gaz:
- NO
2 + ClO
2 + 2 O
3 → NO
2ClO
4 + 2 O
2 ⓘ
Ozon amonyum tuzları ile reaksiyona girmez, ancak amonyağı amonyum nitrata okside eder:
- 2 NH
3 + 4 O
3 → NH
4NO
3 + 4 O
2 + H
2O ⓘ
Ozon, oda sıcaklığında bile karbon ile reaksiyona girerek karbondioksit oluşturur:
- C + 2 O
3 → CO
2 + 2 O
2 ⓘ
Sülfür bileşikleri ile
Ozon sülfürleri sülfatlara okside eder. Örneğin, kurşun(II) sülfür kurşun(II) sülfata oksitlenir:
- PbS + 4 O3 → PbSO4 + 4 O2 ⓘ
Sülfürik asit ozon, su ve elementel sülfür ya da sülfür dioksitten üretilebilir:
- S + H2O + O3 → H2SO4
- 3 SO2 + 3 H2O + O3 → 3 H2SO4 ⓘ
Gaz fazında, ozon hidrojen sülfür ile reaksiyona girerek sülfür dioksit oluşturur:
- H2S + O3 → SO2 + H2O ⓘ
Ancak sulu bir çözeltide, biri elementel sülfür, diğeri de sülfürik asit üretmek üzere birbiriyle yarışan iki eşzamanlı reaksiyon meydana gelir:
- H2S + O3 → S + O2 + H2O
- 3 H2S + 4 O3 → 3 H2SO4 ⓘ
Alkenler ve alkinler ile
Alkenler, ozonoliz adı verilen bir süreçte ozon tarafından oksidatif olarak parçalanabilir ve işlemin ikinci adımına bağlı olarak alkoller, aldehitler, ketonlar ve karboksilik asitler verir. ⓘ
Ozon ayrıca alkinleri parçalayarak bir asit anhidrit veya diketon ürünü oluşturabilir. Reaksiyon su varlığında gerçekleştirilirse, anhidrit iki karboksilik asit vermek üzere hidrolize olur. ⓘ
Genellikle ozonoliz -78 °C sıcaklıkta bir diklorometan çözeltisi içinde gerçekleştirilir. Bir dizi bölünme ve yeniden düzenlemeden sonra, organik bir ozonid oluşur. İndirgeyici işlemle (örneğin asetik asit veya dimetil sülfür içinde çinko) ketonlar ve aldehitler, oksidatif işlemle (örneğin sulu veya alkollü hidrojen peroksit) karboksilik asitler oluşacaktır. ⓘ
Diğer substratlar
Kalay(II) klorürün hidroklorik asit ve ozon ile reaksiyonunda olduğu gibi ozonun üç atomu da reaksiyona girebilir:
İyot perklorat, soğuk susuz perklorik asit içinde çözünmüş iyotun ozon ile muamele edilmesiyle elde edilebilir:
Ozon ayrıca potasyum iyodür ile reaksiyona girerek kantitatif tayin için titre edilebilen oksijen ve iyot gazı verebilir:
- Ayrıştırılamadı (sözdizim hatası): {\displaystyle \ce{2KI + O3 + H2O -> 2KOH + O2 + I2 <span title="Kaynak: İngilizce Vikipedi, Bölüm "Other substrates"" class="plainlinks">[https://en.wikipedia.org/wiki/Ozone#Other_substrates <span style="color:#dddddd">ⓘ</span>]</span>}}
Yanma
Ozon yanma reaksiyonları ve yanıcı gazlar için kullanılabilir; ozon dioksijen (O2) içinde yanmaya göre daha yüksek sıcaklıklar sağlar. Aşağıda karbon subnitrürün yanması için daha yüksek sıcaklıklara da neden olabilen bir reaksiyon verilmiştir:
- 3 C
4N
2 + 4 O
3 → 12 CO + 3 N
2 ⓘ
Ozon kriyojenik sıcaklıklarda reaksiyona girebilir. 77 K'de (-196,2 °C; -321,1 °F) atomik hidrojen, dimerize olan bir hidrojen süperoksit radikali oluşturmak için sıvı ozonla reaksiyona girer:
- H + O
3 → HO2 + O - 2 HO2 → H
2O
4 ⓘ
Ozon ayrışması
Ozon ayrışma türleri
Ozon, insan ortamlarında (uçak kabinleri, fotokopi makineli ofisler, lazer yazıcılar, sterilizatörler...) yaygın olarak bulunan veya üretilen toksik bir maddedir ve katalitik ayrışması kirliliği azaltmak için çok önemlidir. Bu tür ayrıştırma, özellikle katı katalizörlerle en yaygın olarak kullanılanıdır ve daha düşük sıcaklıkta daha yüksek dönüşüm gibi birçok avantajı vardır. Ayrıca, ürün ve katalizör anında ayrıştırılabilir ve bu şekilde katalizör herhangi bir ayrıştırma işlemi kullanılmadan kolayca geri kazanılabilir. Ayrıca, ozonun gaz fazında katalitik ayrışmasında en çok kullanılan malzemeler Pt, Rh veya Pd gibi soy metaller ve Mn, Co, Cu, Fe, Ni veya Ag gibi geçiş metalleridir. ⓘ
Ozonun gaz fazında ayrışması için iki olasılık daha vardır: Birincisi, ozonun sadece ısı etkisi kullanılarak ayrıştırılabildiği termal ayrışmadır. Sorun, bu tür bir ayrışmanın 250 °C'nin altındaki sıcaklıklarda çok yavaş olmasıdır. Bununla birlikte, ayrışma hızı daha yüksek sıcaklıklarla artırılabilir, ancak bu yüksek bir enerji maliyeti gerektirecektir. ⓘ
İkincisi, ozonun ultraviyole radyasyon (UV) ile ışınlanmasından oluşan ve oksijen ve radikal peroksite yol açan fotokimyasal bir ayrışmadır. ⓘ
Ozonun moleküler oksijene ayrışma kinetiği
Ozon ayrışması süreci, sonunda moleküler oksijene yol açan iki temel reaksiyon içeren karmaşık bir reaksiyondur ve bu, reaksiyon sırasının ve hız yasasının, uygun denklemin stokiyometrisi ile belirlenemeyeceği anlamına gelir. ⓘ
Genel reaksiyon: 2 O3 → 3 O2 ⓘ
Hız yasası (gözlenen): V = K - [O3]2 - [O2]-1 ⓘ
Ozon ayrışmasının birinci dereceden bir kinetiği takip ettiği belirlenmiştir ve yukarıdaki hız yasasından, moleküler oksijene göre kısmi sıranın -1 ve ozona göre 2 olduğu, dolayısıyla küresel reaksiyon sırasının 1 olduğu belirlenebilir. ⓘ
Ozon ayrışması iki temel adımdan oluşur: İlki tek moleküllü bir reaksiyona karşılık gelir çünkü ozonun tek bir molekülü iki ürüne (moleküler oksijen ve oksijen) ayrışır. Daha sonra, ilk adımdaki oksijen bir ara üründür çünkü gaz fazındaki moleküler oksijene karşılık gelen tek bir ürüne yol açan iki farklı reaktan (ozon ve oksijen) olduğu için bimoleküler bir reaksiyon olan ikinci adıma reaktan olarak katılır. ⓘ
Adım 1: Tek moleküllü reaksiyon O3 → O2 + O ⓘ
Adım 2: Bimoleküler reaksiyon O3 + O → 2 O2 ⓘ
Bu iki adım farklı reaksiyon hızlarına sahiptir, birincisi tersinirdir ve daha yavaş olan ikinci reaksiyondan daha hızlıdır, bu nedenle belirleyici adımın ikinci reaksiyon olduğu anlamına gelir ve bu, gözlemlenen reaksiyon hızını belirlemek için kullanılır. Her adım için reaksiyon hız yasaları aşağıdaki gibidir: V1 = K1 - [O3] V2 = K2 - [O] - [O3] ⓘ
Aşağıdaki mekanizma, deneysel olarak gözlemlenen ozon ayrışmasının hız yasasını açıklamaya ve ayrıca genel reaksiyon sırasının belirleneceği ozon ve oksijene göre reaksiyon sıralarını belirlemeye izin verir. Daha yavaş adım olan bimoleküler reaksiyon, ürün oluşum hızını belirleyen adımdır ve bu adımın iki oksijen molekülüne yol açtığı düşünüldüğünde, hız kanunu şu şekildedir: V = 2 K2 - [O] - [O3] ⓘ
Ancak bu denklem, ilk adım dikkate alınarak belirlenebilen oksijen (ara ürün) konsantrasyonuna bağlıdır. İlk adım daha hızlı ve tersinir olduğundan ve ikinci adım daha yavaş olduğundan, ilk adımdaki reaktanlar ve ürünler dengededir, bu nedenle ara ürün konsantrasyonu aşağıdaki gibi belirlenebilir: ⓘ
Daha sonra bu denklemler kullanılarak, moleküler oksijen oluşum hızı aşağıda gösterildiği gibidir: ⓘ
Son olarak, sunulan mekanizma, deneysel olarak gözlemlenen hızın, bir hız sabiti (Kobs) ile ve birinci dereceden bir kinetiğe karşılık gelecek şekilde aşağıdaki gibi belirlenmesini sağlar: ⓘ
burada ⓘ
Ozonidlere indirgeme
Ozonun indirgenmesi ozonid anyonunu verir, O-
3. Bu anyonun türevleri patlayıcıdır ve kriyojenik sıcaklıklarda saklanmalıdır. Tüm alkali metaller için ozonidler bilinmektedir. KO3, RbO3 ve CsO3 ilgili süperoksitlerinden hazırlanabilir:
- KO2 + O3 → KO3 + O2
KO3 yukarıdaki gibi oluşabilse de potasyum hidroksit ve ozondan da oluşabilir:
- 2 KOH + 5 O3 → 2 KO3 + 5 O2 + H2O
NaO3 ve LiO3, sıvı NH3 içindeki CsO3'ün Na+ veya Li+ iyonları içeren bir iyon değiştirici reçine üzerindeki etkisiyle hazırlanmalıdır:
- CsO3 + Na+ → Cs+ + NaO3
Amonyak içindeki bir kalsiyum çözeltisi ozonla tepkimeye girerek kalsiyum ozonid değil amonyum ozonid verir:
- 3 Ca + 10 NH3 + 6 O
3 → Ca-6NH3 + Ca(OH)2 + Ca(NO3)2 + 2 NH4O3 + 2 O2 + H2 ⓘ
Uygulamalar
Ozon, filtrelenebilen bir çökelti oluşturarak demir ve manganezi sudan uzaklaştırmak için kullanılabilir:
- 2 Fe2+ + O3 + 5 H2O → 2 Fe(OH)3(s) + O2 + 4 H+
- 2 Mn2+ + 2 O3 + 4 H2O → 2 MnO(OH)2(s) + 2 O2 + 4 H+
Ozon ayrıca sudaki çözünmüş hidrojen sülfürü sülfürik aside oksitleyecektir:
- 3 O
3 + H2S → H2SO3 + 3 O2 ⓘ
Bu üç reaksiyon, ozon bazlı kuyu suyu arıtımının merkezinde yer alır. ⓘ
Ozon ayrıca siyanürleri siyanatlara dönüştürerek detoksifiye edecektir.
- CN- + O3 → CNO-
+ O2 ⓘ
Ozon ayrıca üreyi de tamamen ayrıştıracaktır:
- (NH2)2CO + O3 → N2 + CO2 + 2 H2O ⓘ
Spektroskopik özellikler
Ozon üç titreşim moduna sahip bükülmüş triatomik bir moleküldür: simetrik gerilme (1103.157 cm-1), bükülme (701.42 cm-1) ve antisimetrik gerilme (1042.096 cm-1). Simetrik gerilme ve bükülme zayıf emicilerdir, ancak antisimetrik gerilme güçlüdür ve ozonun önemli bir küçük sera gazı olmasından sorumludur. UV tabanlı ölçümler daha yaygın olmasına rağmen, bu IR bandı ortam ve atmosferik ozonu tespit etmek için de kullanılır. ⓘ
Ozonun elektromanyetik spektrumu oldukça karmaşıktır. Genel bir bakış MPI Mainz UV/VIS Spectral Atlas of Gaseous Molecules of Atmospheric Interest'de görülebilir. ⓘ
Tüm bantlar dissosiyatiftir, yani molekül bir foton emdikten sonra O + O2'ye ayrılır. En önemli soğurma, 300 nm'nin biraz üstünden 200 nm'nin biraz üstüne kadar uzanan Hartley bandıdır. Stratosferdeki UV C'nin emilmesinden sorumlu olan bu banttır. ⓘ
Yüksek dalga boyu tarafında Hartley bandı, ~360 nm'de kaybolana kadar hızla düşen Huggins bandına geçiş yapar. 400 nm'nin üzerinde, NIR'ye doğru uzanan Chappius ve Wulf bantları vardır. Burada, yapılandırılmamış absorpsiyon bantları yüksek ortam ozon konsantrasyonlarını tespit etmek için yararlıdır, ancak o kadar zayıftırlar ki pratikte pek bir etkileri yoktur. ⓘ
Uzak UV'de 200 nm'den aşağıya doğru yavaşça artarak ~120 nm'de maksimuma ulaşan ek emilim bantları vardır. ⓘ
Dünya atmosferindeki ozon


Atmosferdeki toplam ozon seviyelerini (belirli bir dikey sütundaki ozon miktarı) ifade etmenin standart yolu Dobson birimlerini kullanmaktır. Noktasal ölçümler nmol/mol (milyarda parça, ppb) cinsinden mol kesirleri veya μg/m3 cinsinden konsantrasyonlar olarak rapor edilir. Atmosferdeki ozon konsantrasyonu çalışmaları 1920'lerde başlamıştır. ⓘ
Ozon tabakası
Konum ve üretim
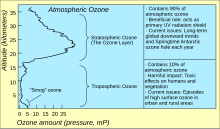
Atmosferdeki en yüksek ozon seviyeleri stratosferde, yüzeyden yaklaşık 10 km ila 50 km (veya yaklaşık 6 ila 31 mil) yükseklikte ozon tabakası olarak da bilinen bir bölgededir. Bununla birlikte, bu "katmanda" bile ozon konsantrasyonları milyonda sadece iki ila sekiz parçadır, bu nedenle buradaki oksijenin çoğu, hacim olarak milyonda yaklaşık 210.000 parça olan dioksijen, O2'dir. ⓘ
Stratosferdeki ozon çoğunlukla 240 ila 160 nm arasındaki kısa dalga ultraviyole ışınlarından üretilir. Oksijen 240 nm'de Herzberg bantlarında zayıf bir şekilde absorbe olmaya başlar, ancak oksijenin çoğu ozonun absorbe olmadığı 200 ve 160 nm arasındaki güçlü Schumann-Runge bantlarında absorbe olarak ayrışır. X-Işını sınırına kadar uzanan daha kısa dalga boylu ışık, moleküler oksijeni ayrıştıracak kadar enerjik olsa da, nispeten az miktarda bulunur ve Lyman-alfa, 121 nm'deki güçlü güneş emisyonu, moleküler oksijen emiliminin minimum olduğu bir noktaya denk gelir. ⓘ
Ozon yaratma ve yok etme süreci Chapman döngüsü olarak adlandırılır ve moleküler oksijenin fotolizi ile başlar ⓘ
ardından oksijen atomunun başka bir oksijen molekülü ile reaksiyona girerek ozon oluşturması.
- O + O
2 + M → O
3 + M ⓘ
Burada "M", reaksiyonun fazla enerjisini taşıyan üçüncü cismi ifade eder. Ozon molekülü daha sonra bir UV-C fotonunu emebilir ve ayrışabilir ⓘ
- O
3 → O + O
2 + kinetik enerji ⓘ
Aşırı kinetik enerji, O atomları ve moleküler oksijen parçalanıp diğer moleküllerle çarpıştığında stratosferi ısıtır. UV ışığının bu şekilde kinetik enerjiye dönüşmesi stratosferi ısıtır. Ozonun fotolizinde üretilen oksijen atomları daha sonra daha fazla ozon oluşturmak için bir önceki adımda olduğu gibi diğer oksijen molekülü ile tekrar reaksiyona girer. Sadece azot ve oksijenin bulunduğu berrak atmosferde, ozon atomik oksijen ile reaksiyona girerek iki molekül O2 oluşturabilir ⓘ
- O
3 + O → 2 O
2 ⓘ
Atomik oksijenin ozona dönüĢümü için bu sonlandırma aĢamasının oranının tahmini, O2 konsantrasyonunun O3'e oranı alınarak bulunabilir. Sonlandırma reaksiyonu, en önemlileri hidroksil (OH), nitrik oksit (NO) ve atomik klor (Cl) ve brom (Br) olan bazı serbest radikallerin varlığı ile katalize edilir. Yirminci yüzyılın ikinci yarısında, stratosferdeki ozon miktarının, çoğunlukla kloroflorokarbonların (CFC) ve benzer klorlu ve bromlu organik moleküllerin artan konsantrasyonları nedeniyle azaldığı keşfedilmiştir. Bu düşüşün sağlık üzerindeki etkilerinden duyulan endişe 1987 Montreal Protokolü'nün imzalanmasına, ozon tabakasını incelten birçok kimyasalın üretiminin yasaklanmasına ve 21. yüzyılın ilk ve ikinci on yılında stratosferik ozon konsantrasyonlarının iyileşmeye başlamasına yol açmıştır. ⓘ
Dünya yüzeyinde yaşayan canlılar için önemi

Ozon tabakasındaki ozon, yaklaşık 200 nm UV ışınlarından 315 nm'ye kadar olan güneş ışığı dalga boylarını filtreler ve ozonun tepe emilimi yaklaşık 250 nm'dir. Bu ozon UV emilimi yaşam için önemlidir, çünkü UV'nin havadaki normal oksijen ve nitrojen tarafından emilimini (200 nm'den küçük tüm dalga boylarını emen) daha düşük UV-C (200-280 nm) ve tüm UV-B bandı (280-315 nm) boyunca genişletir. UV-B'nin ozondan geçtikten sonra kalan küçük emilmemiş kısmı insanlarda güneş yanığına ve hem bitkilerde hem de hayvanlarda canlı dokularda doğrudan DNA hasarına neden olur. Ozonun orta menzilli UV-B ışınları üzerindeki etkisi, atmosferin tepesinde yüzeydekinden 350 milyon kat daha güçlü bir radyasyon yoğunluğuna sahip olan 290 nm'deki UV-B üzerindeki etkisiyle gösterilmektedir. Bununla birlikte, benzer frekanstaki UV-B radyasyonu yere ulaşarak bir miktar güneş yanığına neden olur ve aynı dalga boyları insanlarda D vitamini üretiminden sorumlu olanlar arasındadır. ⓘ
Ozon tabakasının UV-A (315-400 nm) olarak adlandırılan daha uzun UV dalga boyları üzerinde çok az etkisi vardır, ancak bu radyasyon güneş yanığına veya doğrudan DNA hasarına neden olmaz ve muhtemelen bazı insanlarda uzun vadeli cilt hasarına neden olsa da, bitkiler ve genel olarak Dünya'da yüzeyde yaşayan organizmaların sağlığı için o kadar tehlikeli değildir (yakın ultraviyole hakkında daha fazla bilgi için bkz. ultraviyole). ⓘ
Düşük seviyeli ozon
| Üzerine bir serinin parçası ⓘ |
| Kirlilik |
|---|
 |
|
|
Düşük seviyeli ozon (veya troposferik ozon) atmosferik bir kirleticidir. Doğrudan araba motorları veya endüstriyel faaliyetler tarafından yayılmaz, ancak güneş ışığının hidrokarbonlar ve nitrojen oksitleri içeren hava üzerinde reaksiyona girerek doğrudan kirliliğin kaynağında veya kilometrelerce rüzgar altında ozon oluşturmasıyla oluşur. ⓘ
Ozon, aldehitler gibi bazı hidrokarbonlarla doğrudan reaksiyona girer ve böylece bunların havadan uzaklaştırılmasını başlatır, ancak ürünlerin kendileri smogun temel bileşenleridir. UV ışığı ile ozon fotolizi hidroksil radikali HO- üretimine yol açar ve bu hidrokarbonların havadan uzaklaştırılmasında rol oynar, ancak aynı zamanda güçlü göz tahriş edici olabilen peroksiasil nitratlar gibi smog bileşenlerinin oluşumunda ilk adımdır. Troposferik ozonun atmosferik ömrü yaklaşık 22 gündür; ana uzaklaştırma mekanizmaları yere çökelme, yukarıda bahsedilen HO- veren reaksiyon ve OH ve peroksi radikali HO2- ile reaksiyonlardır. ⓘ
Fotosenteze müdahale eden ve bazı bitki türlerinin genel büyümesini engelleyen yer seviyesindeki ozon ve kirliliğin artması nedeniyle tarımsal verimde önemli düşüşler olduğuna dair kanıtlar bulunmaktadır. Amerika Birleşik Devletleri Çevre Koruma Ajansı, insan sağlığının korunması için tasarlanan birincil düzenlemeye ek olarak, mahsul hasarını azaltmak için ikincil bir düzenleme önermektedir. ⓘ
Kentsel alanlarda düşük seviyeli ozon
Yüksek ozon değerlerine sahip bazı şehir örnekleri Denver, Colorado; Houston, Texas; ve Mexico City, Meksika'dır. Houston yaklaşık 41 nmol/mol değerine sahipken, Mexico City yaklaşık 125 nmol/mol değeriyle çok daha tehlikelidir. ⓘ
Düşük seviyeli ozon veya troposferik ozon, kentsel alanlardaki en endişe verici ozon kirliliği türüdür ve genel olarak artmaktadır. Kentsel alanlardaki ozon kirliliği daha yoğun nüfusları etkiler ve sorunlu ozon seviyelerine ana katkıda bulunan NO2 ve VOC kirleticilerini yayan yüksek araç nüfusları nedeniyle daha da kötüleşir. Kentsel alanlardaki ozon kirliliği, özellikle artan sıcaklıklarla birlikte, sıcak hava dalgaları sırasında ısıya bağlı ölümleri artırmaktadır. Kentsel alanlardaki sıcak hava dalgaları sırasında, yer seviyesindeki ozon kirliliği normalden %20 daha yüksek olabilir. Kentsel alanlardaki ozon kirliliği yaz ve sonbahar aylarında daha yüksek aşım seviyelerine ulaşmaktadır ve bu durum hava durumu ve trafik düzeniyle açıklanabilir. Özellikle kentsel alanlarda hangi nüfusun ozondan daha fazla etkilendiğine ilişkin daha fazla araştırma yapılması gerekmektedir; çünkü beyaz olmayanlar ve yoksulluk yaşayanlar, kirlilik seviyelerine katkıda bulunma olasılıkları daha düşük olsa da genel olarak kirlilikten daha fazla etkilenmektedir. ⓘ
Yukarıda da belirtildiği gibi, Denver, Colorado, Amerika Birleşik Devletleri'nde yüksek miktarda ozona sahip birçok şehirden biridir. Amerikan Akciğer Derneği'ne göre Denver-Aurora bölgesi Amerika Birleşik Devletleri'nde ozon kirliliğinin en yüksek olduğu 14. bölgedir. Yüksek ozon seviyeleri sorunu bu bölge için yeni değildir. 2004 yılında "ABD Çevre Koruma Ajansı Denver Metro/North Front Range'i (Adams, Arapahoe, Boulder, Broomfield, Denver, Douglas, Jefferson ve Larimer ve Weld ilçelerinin bir kısmı) 1997 8 saatlik ozon standardı için ulaşılamaz olarak belirlemiş", ancak daha sonra bu ulaşılamazlık durumunu 2007 yılına kadar ertelemiştir. Ulaşılamazlık standardı, bir bölgenin EPA'nın hava kalitesi standartlarını karşılamadığını gösterir. Bunun üzerine Colorado Ozon Eylem Planı oluşturuldu ve bu planda çok sayıda değişiklik yapıldı. İlk büyük değişiklik, otomobil emisyon testinin eyalet genelinde Larimer ve Weld County bölgeleri gibi daha önce emisyon testini zorunlu kılmayan daha fazla ilçeye genişletilmesiydi. Ozon seviyelerinin düşürülmesine yardımcı olacak Azot Oksitleri (NOx) ve Uçucu Organik Bileşik (VOC) emisyonlarını azaltmak için de değişiklikler yapılmıştır. ⓘ
Bölgedeki yüksek ozon seviyelerine büyük katkıda bulunanlardan biri, Colorado'nun metropol alanlarının çoğuyla örtüşen Denver-Julesburg Havzasında (DJB) bulunan petrol ve doğal gaz endüstrisidir. Ozon Dünya'nın stratosferinde doğal olarak oluşur, ancak troposferde insan çabalarıyla da yaratılır. Yukarıda kısaca bahsedildiği üzere, NOx ve VOC'ler güneş ışığı ile reaksiyona girerek fotokimya adı verilen bir süreçle ozon oluşturur. Bir saatlik yüksek ozon olayları (<75 ppb) "Haziran-Ağustos aylarında meydana gelir ve bu da yüksek ozon seviyelerinin bölgesel fotokimya tarafından yönlendirildiğini gösterir". Colorado-Boulder Üniversitesi'nden bir makaleye göre, "Petrol ve doğal gaz VOC emisyonu ozon üretiminde önemli bir role sahiptir ve Kuzey Colorado Front Range'deki (NCFR) yüksek O3 seviyelerine katkıda bulunma potansiyeli taşımaktadır". Büyük petrol ve doğal gaz operasyonlarından kaynaklanan emisyonları ve rüzgar modellerini araştırmak için karmaşık analizler kullanan yazarlar, "NCFR'deki yüksek O3 seviyelerinin ağırlıklı olarak DJB'nin Wattenberg Field bölgesindeki O&NG operasyonlarının bulunduğu rüzgar üstü sektörler olan N-ESE'den hava taşımacılığı ile ilişkili olduğu" sonucuna varmışlardır. ⓘ
2008'de oluşturulan Colorado Ozon Eylem Planında, "büyük endüstriyel NOx kaynakları için emisyon kontrolleri" ve "yeni petrol ve gaz kondensat tankları ve pnömatik valfler için eyalet çapında kontrol gerekliliklerini" değerlendirmek için planlar mevcuttur. 2011 yılında, NOx emisyonlarının azaltılmasına yardımcı olacak daha spesifik bir plan içeren Bölgesel Pus Planı yayınlandı. Bu çabaların uygulanması giderek zorlaşmakta ve hayata geçirilmesi uzun yıllar almaktadır. Elbette ozon seviyelerinin yüksek kalmasının başka nedenleri de var. Bunlar arasında artan nüfusun daha fazla araba emisyonu anlamına gelmesi ve NCFR boyunca uzanan dağların emisyonları hapsetmesi sayılabilir. İlgilenenler günlük hava kalitesi ölçümlerini Colorado Halk Sağlığı ve Çevre Departmanı'nın web sitesinde bulabilirler. Daha önce de belirtildiği gibi, Denver bugün de yüksek ozon seviyeleri yaşamaya devam etmektedir. Colorado'nun Front Range bölgesindeki bu yüksek ozon seviyeleri sorunuyla mücadele etmek uzun yıllar ve sistem odaklı bir yaklaşım gerektirecektir. ⓘ
Ozon çatlaması

Ozon gazı, doğal kauçuk, nitril kauçuk ve stiren-bütadien kauçuk gibi zincir yapısında olefinik veya çift bağ bulunan tüm polimerlere saldırır. Bu polimerler kullanılarak üretilen ürünler saldırıya karşı özellikle hassastır, bu da çatlakların zamanla daha uzun ve daha derin büyümesine neden olur, çatlak büyüme hızı kauçuk bileşen tarafından taşınan yüke ve atmosferdeki ozon konsantrasyonuna bağlıdır. Bu tür malzemeler, koruyucu bir film oluşturmak için yüzeye bağlanan veya malzeme ile karışan ve uzun süreli koruma sağlayan mumlar gibi antiozonantlar eklenerek korunabilir. Örneğin, ozon çatlaması eskiden otomobil lastiklerinde ciddi bir sorundu, ancak modern lastiklerde bu bir sorun değildir. Öte yandan, contalar ve O-ringler gibi birçok kritik ürün, basınçlı hava sistemlerinde üretilen ozon tarafından saldırıya uğrayabilir. Güçlendirilmiş kauçuktan yapılmış yakıt hatları da, özellikle elektrikli bileşenler tarafından bir miktar ozonun üretildiği motor bölmesinde, saldırıya karşı hassastır. Kauçuk ürünlerin bir DC elektrik motorunun yakınında depolanması ozon çatlamasını hızlandırabilir. Motorun komütatörü kıvılcım üretir ve bu da ozon üretir. ⓘ
Bir sera gazı olarak ozon
Ozon, Sanayi Devrimi'nden önce yer seviyesinde mevcut olmasına rağmen, en yüksek konsantrasyonlar şu anda sanayi öncesi seviyelerden çok daha yüksektir ve kirlilik kaynaklarından oldukça uzakta olan arka plan konsantrasyonları bile önemli ölçüde daha yüksektir. Ozon, yeryüzünden yayılan kızılötesi enerjinin bir kısmını emerek sera gazı görevi görür. Ozonun sera gazı etkisini ölçmek zordur çünkü dünya genelinde aynı konsantrasyonlarda bulunmaz. Bununla birlikte, iklim değişikliğiyle ilgili en yaygın kabul gören bilimsel değerlendirmeler (örneğin Hükümetlerarası İklim Değişikliği Paneli Üçüncü Değerlendirme Raporu) troposferik ozonun ışınımsal zorlamasının karbondioksitin yaklaşık %25'i kadar olduğunu öne sürmektedir. ⓘ
Troposferik ozonun yıllık küresel ısınma potansiyeli 918 ila 1022 ton karbondioksit eşdeğeri/ton troposferik ozon arasındadır. Bu, molekül bazında, troposferdeki ozonun karbondioksitten kabaca 1.000 kat daha güçlü bir radyatif zorlama etkisine sahip olduğu anlamına gelir. Ancak troposferik ozon kısa ömürlü bir sera gazıdır ve atmosferde karbondioksite kıyasla çok daha hızlı bozunur. Bu da 20 yıllık bir süre zarfında troposferik ozonun küresel ısınma potansiyelinin çok daha az olduğu anlamına gelir; kabaca 62 ila 69 ton karbondioksit eşdeğeri/ton troposferik ozon. ⓘ
Kısa ömürlü doğası nedeniyle troposferik ozonun güçlü küresel etkileri yoktur, ancak bölgesel ölçeklerde çok güçlü ışınımsal zorlama etkileri vardır. Aslında, dünyada troposferik ozonun karbondioksitin %150'sine kadar radyatif zorlamaya sahip olduğu bölgeler vardır. Örneğin, troposferdeki ozon artışının 1955 ve 2000 yılları arasında üst Güney Okyanusu iç ısınmasının ~%30'undan sorumlu olduğu gösterilmiştir. ⓘ
Sağlık etkileri
Son birkaç on yıldır bilim insanları akut ve kronik ozon maruziyetinin insan sağlığı üzerindeki etkilerini incelemektedir. Yüzlerce çalışma, ozonun şu anda kentsel alanlarda bulunan seviyelerde insanlar için zararlı olduğunu göstermektedir. Ozonun solunum, kardiyovasküler ve merkezi sinir sistemini etkilediği gösterilmiştir. Erken ölüm ve üreme sağlığı ve gelişimindeki sorunların da ozon maruziyeti ile ilişkili olduğu gösterilmiştir. ⓘ
Hassas popülasyonlar
Amerikan Akciğer Derneği, ozon solumanın etkilerine karşı özellikle savunmasız olan beş popülasyon belirlemiştir:
- Çocuklar ve gençler
- 65 yaş ve üzeri kişiler
- Açık havada çalışan veya egzersiz yapan kişiler
- Astım ve kronik obstrüktif akciğer hastalığı (KOAH olarak da bilinir, amfizem ve kronik bronşiti içerir) gibi mevcut akciğer hastalıkları olan kişiler
- Kardiyovasküler hastalığı olan kişiler
Ek kanıtlar, daha fazla araştırmaya ihtiyaç duyulmasına rağmen, kadınların, obezite hastalarının ve düşük gelirli nüfusun da ozondan daha yüksek riskle karşı karşıya kalabileceğini göstermektedir. ⓘ
Akut ozon maruziyeti
Akut ozon maruziyeti saatler ile birkaç gün arasında değişir. Ozon bir gaz olduğu için akciğerleri ve tüm solunum sistemini doğrudan etkiler. Solunan ozon iltihaplanmaya ve akciğer fonksiyonlarında akut ancak geri döndürülebilir değişikliklere ve ayrıca hava yolu aşırı duyarlılığına neden olur. Bu değişiklikler nefes darlığı, hırıltılı solunum ve öksürüğe yol açarak astım veya kronik obstrüktif akciğer hastalığı (KOAH) gibi akciğer hastalıklarını şiddetlendirebilir ve tıbbi tedaviye ihtiyaç duyulmasına neden olabilir. Akut ve kronik ozon maruziyetinin, aşağıdaki mekanizma nedeniyle solunum yolu enfeksiyonları riskinde artışa neden olduğu gösterilmiştir. ⓘ
Ozonun özellikle akciğerlerdeki zararlı etkilerinin arkasındaki mekanizmayı belirlemek için çok sayıda çalışma yapılmıştır. Bu çalışmalar, ozona maruz kalmanın akciğer dokusu içindeki bağışıklık yanıtında değişikliklere neden olduğunu, bunun da hem doğal hem de adaptif bağışıklık yanıtının bozulmasına ve akciğer epitel hücrelerinin koruyucu işlevinin değişmesine yol açtığını göstermiştir. Bağışıklık yanıtındaki bu değişikliklerin ve ilgili enflamatuar yanıtın, yer seviyesindeki ozon kirliliğine maruz kaldıktan sonra akciğer enfeksiyonu riskinin artmasına, astım ve reaktif hava yollarının kötüleşmesine veya tetiklenmesine katkıda bulunan faktörler olduğu düşünülmektedir. ⓘ
Doğuştan gelen (hücresel) bağışıklık sistemi, tipik olarak bakteriler veya konakçıdaki yabancı cisimler/maddeler olmak üzere çoklu patojen tiplerine karşı geniş çapta çalışan çeşitli kimyasal sinyaller ve hücre tiplerinden oluşur. Doğuştan gelen sistemin hücreleri arasında fagositler, nötrofiller yer alır ve her ikisinin de akciğerlerdeki ozon patolojisi mekanizmasına katkıda bulunduğu düşünülmektedir, çünkü bu hücre tiplerinin işleyişinin ozona maruz kaldıktan sonra değiştiği gösterilmiştir. "Fagositoz" süreci yoluyla patojenleri veya yabancı maddeleri ortadan kaldırma amacına hizmet eden hücreler olan makrofajların, ozona yanıt olarak saldıkları enflamatuar sinyallerin seviyesini değiştirdikleri, ya yukarı doğru düzenleyerek akciğerde enflamatuar bir yanıtla sonuçlandıkları ya da aşağı doğru düzenleyerek bağışıklık korumasını azalttıkları gösterilmiştir. Öncelikle bakteriyel patojenleri hedef alan doğuştan gelen bağışıklık sisteminin bir diğer önemli hücre tipi olan nötrofillerin, yüksek ozon seviyelerine maruz kaldıktan sonraki 6 saat içinde solunum yollarında mevcut olduğu bulunmuştur. Ancak akciğer dokularındaki yüksek seviyelerine rağmen, bakterileri temizleme yetenekleri ozona maruz kalındığında bozulmuş görünmektedir. ⓘ
Adaptif bağışıklık sistemi, spesifik patojenleri hedefleyen antikorların geliştirilmesi yoluyla uzun vadeli koruma sağlayan bağışıklık dalıdır ve yüksek ozon maruziyetinden de etkilenir. Adaptif bağışıklık tepkisinin hücresel bir bileşeni olan lenfositler, ozona maruz kaldıktan sonra "sitokin" adı verilen ve hava yolu hiperreaktivitesine ve astım semptomlarının kötüleşmesine katkıda bulunabilecek artan miktarda enflamatuar kimyasal üretir. ⓘ
Hava yolu epitel hücreleri de bireylerin patojenlerden korunmasında önemli bir rol oynar. Normal dokuda, epitel tabakası koruyucu bir bariyer oluşturur ve ayrıca yabancı cisimleri, mukusu ve patojenleri akciğerlerden temizlemek için çalışan özelleşmiş siliyer yapılar içerir. Ozona maruz kalındığında, kirpikler hasar görür ve patojenlerin mukosiliyer temizliği azalır. Ayrıca, epitelyal bariyer zayıflar ve patojenlerin bariyeri geçmesine, çoğalmasına ve daha derin dokulara yayılmasına izin verir. Epitel bariyerindeki bu değişiklikler birlikte, bireylerin akciğer enfeksiyonlarına karşı daha duyarlı hale gelmesine yardımcı olur. ⓘ
Ozon solumak sadece bağışıklık sistemini ve akciğerleri etkilemekle kalmaz, aynı zamanda kalbi de etkileyebilir. Ozon kısa süreli otonomik dengesizliğe yol açarak kalp atış hızında değişikliklere ve kalp atış hızı değişkenliğinde azalmaya neden olur; bir saat gibi kısa bir süre boyunca yüksek düzeyde maruz kalınması ise yaşlılarda supraventriküler aritmiye yol açar ve her ikisi de erken ölüm ve felç riskini artırır. Ozon ayrıca vazokonstriksiyona yol açarak sistemik arter basıncının artmasına neden olabilir ve önceden kalp hastalığı olan hastalarda kardiyak morbidite ve mortalite riskinin artmasına katkıda bulunabilir. ⓘ
Kronik ozon maruziyeti
Haftalar, aylar veya yıllar boyunca bir seferde sekiz saatten daha uzun süre ozon solumak kronik maruziyeti tanımlar. Çok sayıda çalışma, bu maruziyetin çeşitli popülasyonların sağlığı üzerinde ciddi bir etkisi olduğunu göstermektedir. ⓘ
Bir çalışma, kronik ozon ile tüm nedenlere bağlı, dolaşım ve solunum kaynaklı ölümler arasında 10 ppb başına %2, %3 ve %12 risk artışı ile anlamlı pozitif ilişkiler bulmuş ve yıllık ozon ile tüm nedenlere bağlı ölümler arasında 1,02 (1,01-1,04) ve kardiyovasküler ölümler arasında 1,03 (1,01-1,05) tehlike oranı ile bir ilişki (%95 CI) rapor etmiştir. Benzer bir çalışmada, tüm nedenlere bağlı mortalite ile benzer ilişkiler ve kardiyovasküler mortalite için daha da büyük etkiler bulunmuştur. Solunum nedenli ölüm riskinde artış, uzun süreli kronik ozon maruziyeti ile ilişkilidir. ⓘ
Kronik ozonun çocuklar, özellikle de astımı olanlar üzerinde zararlı etkileri vardır. Astımlı çocuklarda hastaneye yatma riski kronik ozon maruziyeti ile artar; küçük çocuklar ve düşük gelirli olanlar daha da büyük risk altındadır. ⓘ
Solunum yolu hastalıklarından (astım, KOAH, akciğer kanseri) muzdarip yetişkinler daha yüksek mortalite ve morbidite riski altındadır ve kritik durumdaki hastalarda da kronik ozon maruziyeti ile akut solunum sıkıntısı sendromu gelişme riski artmaktadır. ⓘ
Hava temizleyicileri tarafından üretilen ozon
Hava temizleyici olarak satılan ozon jeneratörleri kasıtlı olarak ozon gazı üretir. Bunlar genellikle iç mekan hava kirliliğini kontrol etmek için pazarlanır ve ozonu tanımlamak için yanıltıcı terimler kullanır. Bazı örnekler, ozonun sağlıklı veya "daha iyi" bir oksijen türü olduğunu öne sürerek onu "enerjilendirilmiş oksijen" veya "saf hava" olarak tanımlamaktadır. Ancak EPA'ya göre, "ozon kokuya neden olan birçok kimyasalın giderilmesinde etkili değildir" ve "virüsleri, bakterileri, küfü veya diğer biyolojik kirleticileri etkili bir şekilde gidermez". Ayrıca, başka bir raporda "bazı kontrollü çalışmaların sonuçlarının, bir kullanıcı üreticinin kullanım talimatlarına uysa bile bu [insan güvenliği] standartlarından çok daha yüksek ozon konsantrasyonlarının mümkün olduğunu gösterdiği" belirtilmektedir. ⓘ
Kaliforniya Hava Kaynakları Kurulu, milyonda 0.050 parça olan iç mekan ozon sınırını karşılayan hava temizleyicileri (çoğu iyonlaştırıcılı) listeleyen bir sayfaya sahiptir. Bu makaleden:
| Kaliforniya'da satılan tüm taşınabilir iç mekan hava temizleme cihazlarının Kaliforniya Hava Kaynakları Kurulu (CARB) tarafından onaylanmış olması gerekmektedir. Sertifika alabilmek için, hava temizleme cihazlarının elektrik güvenliği ve ozon emisyonları açısından test edilmesi ve milyonda 0,050 parça ozon emisyon konsantrasyonu sınırını karşılaması gerekmektedir. Yönetmelik hakkında daha fazla bilgi için hava temizleyici yönetmeliğini ziyaret edin. ⓘ |
Ozon hava kirliliği

Ozon öncülleri, ağırlıklı olarak fosil yakıtların yanması sırasında yayılan bir grup kirleticidir. Yer seviyesindeki ozon kirliliği (troposferik ozon), gün ışığının UV ışınlarının bu öncüller üzerindeki etkisiyle Dünya yüzeyinin yakınında oluşur. Yer seviyesindeki ozon esas olarak fosil yakıt öncüllerinden kaynaklanır, ancak metan doğal bir öncüldür ve yer seviyesindeki ozonun çok düşük doğal arka plan seviyesi güvenli kabul edilir. Bu bölümde, yer seviyesindeki ozonu arka plan seviyelerinin çok üzerine çıkaran fosil yakıt yakımının sağlık üzerindeki etkileri incelenmektedir. ⓘ
Yer seviyesindeki ozonun akciğer fonksiyonlarına zarar verebileceğini ve solunum sistemini tahriş edebileceğini gösteren çok sayıda kanıt vardır. Ozona (ve onu üreten kirleticilere) maruz kalmak erken ölüm, astım, bronşit, kalp krizi ve diğer kardiyopulmoner sorunlarla bağlantılıdır. ⓘ
Ozona uzun süreli maruz kalmanın solunum yolu hastalıklarından ölüm riskini artırdığı gösterilmiştir. Amerika Birleşik Devletleri şehirlerinde yaşayan 450.000 kişi üzerinde yapılan bir çalışmada, 18 yıllık takip süresi boyunca ozon seviyeleri ile solunum yolu hastalıkları arasında önemli bir korelasyon olduğu görülmüştür. Çalışma, Houston veya Los Angeles gibi yüksek ozon seviyelerine sahip şehirlerde yaşayan insanların akciğer hastalığından ölme riskinin %30'un üzerinde arttığını ortaya koymuştur. ⓘ
Dünya Sağlık Örgütü, Amerika Birleşik Devletleri Çevre Koruma Ajansı (EPA) ve Avrupa Birliği gibi kuruluşların hava kalitesi kılavuzları, ölçülebilir sağlık etkilerine neden olabilecek seviyeleri belirlemek üzere tasarlanmış ayrıntılı çalışmalara dayanmaktadır. ⓘ
ABD EPA'daki bilim adamlarına göre, duyarlı insanlar 40 nmol/mol kadar düşük ozon seviyelerinden olumsuz etkilenebilir. AB'de ozon konsantrasyonları için mevcut hedef değer 120 µg/m3'tür ve bu da yaklaşık 60 nmol/mol'dür. Bu hedef, 2008/50/EC sayılı Direktif uyarınca tüm üye devletler için geçerlidir. Ozon konsantrasyonu 8 saatlik ortalamaların maksimum günlük ortalaması olarak ölçülür ve Ocak 2010'dan itibaren yılda 25 takvim gününden fazla hedefin aşılmaması gerekir. Direktif gelecekte 120 µg/m3 sınırına (yani yılın herhangi bir gününde aşılmaması gereken ortalama ozon konsantrasyonuna) sıkı bir şekilde uyulmasını gerektirse de, bu gereklilik için herhangi bir tarih belirlenmemiştir ve bu uzun vadeli bir hedef olarak ele alınmaktadır. ⓘ
ABD'de Temiz Hava Yasası, EPA'yı yer seviyesindeki ozon da dahil olmak üzere çeşitli kirleticiler için Ulusal Ortam Hava Kalitesi Standartları belirlemeye yönlendirir ve bu standartlara uymayan ilçelerin seviyelerini düşürmek için adımlar atmaları gerekir. Mayıs 2008'de EPA, bir mahkeme kararı uyarınca ozon standardını 80 nmol/mol'den 75 nmol/mol'e düşürdü. Ajansın kendi bilim adamları ve danışma kurulu standardın 60 nmol/mol'e düşürülmesini tavsiye ettiği için bu hamle tartışmalı oldu. Birçok halk sağlığı ve çevre grubu da 60 nmol/mol standardını destekliyordu ve Dünya Sağlık Örgütü 100 µg/m3 (51 nmol/mol) tavsiye ediyordu. ⓘ
7 Ocak 2010 tarihinde, ABD Çevre Koruma Ajansı (EPA), smog'un ana bileşeni olan kirletici ozon için Ulusal Ortam Hava Kalitesi Standardında (NAAQS) önerilen revizyonları açıkladı:
... EPA, 2008 nihai kuralında 0.075 μmol/mol olarak belirlenen 8 saatlik birincil standardın seviyesinin, çocuklar ve diğer risk altındaki nüfuslar için bir dizi Ozon tabakasına karşı daha fazla koruma sağlamak amacıyla 0.060 ila 0.070 μmol/mol aralığında daha düşük bir seviyede belirlenmesini önermektedir.
3 - akciğer fonksiyonlarının azalması ve solunum semptomlarının artmasından, acil servis ziyaretleri ve solunum nedenli hastane kabulleri dahil olmak üzere ciddi solunum morbiditesi göstergelerine ve muhtemelen kardiyovasküler ilişkili morbiditenin yanı sıra toplam kaza dışı ve kardiyopulmoner mortaliteye kadar değişen ilgili olumsuz sağlık etkileri ... ⓘ
26 Ekim 2015 tarihinde EPA, 8 saatlik birincil NAAQS'yi 0.075 ppm'den 0.070 ppm'ye revize eden ve yürürlük tarihi 28 Aralık 2015 olan nihai bir kural yayınlamıştır. ⓘ
EPA, hava kirliliği seviyelerinin halka açıklanmasına yardımcı olmak için bir hava kalitesi endeksi (AQI) geliştirmiştir. Mevcut standartlara göre, sekiz saatlik ortalama ozon mol kesirleri 85 ila 104 nmol/mol "hassas gruplar için sağlıksız", 105 nmol/mol ila 124 nmol/mol "sağlıksız" ve 125 nmol/mol ila 404 nmol/mol "çok sağlıksız" olarak tanımlanmaktadır. ⓘ
Ozon, kısmen fotokopi makineleri gibi elektronik ekipmanların bir sonucu olarak iç mekan hava kirliliğinde de mevcut olabilir. Fırtınaların neden olduğu artan polen, mantar sporları ve ozon ile astım hastalarının hastaneye yatışları arasında da bir bağlantı olduğu bilinmektedir. ⓘ
Viktorya döneminde, bir İngiliz halk efsanesine göre deniz kokusunun nedeni ozondu. Aslında karakteristik "deniz kokusu" fitoplanktonlar tarafından üretilen bir kimyasal olan dimetil sülfürden kaynaklanmaktadır. Viktorya dönemi Britanyalıları ortaya çıkan kokunun "canlandırıcı" olduğunu düşünüyordu. ⓘ
Sıcak hava dalgaları
2003'teki Avrupa sıcak hava dalgaları sırasında ozon ve sıcağın ortak ölüm etkilerini değerlendirmek için yapılan bir araştırma, bunların birbirine eklendiği sonucuna varmıştır. ⓘ
Fizyoloji
Ozon, süperoksit, singlet oksijen, hidrojen peroksit ve hipoklorit iyonları gibi reaktif oksijen formlarıyla birlikte, yabancı cisimleri yok etmek için beyaz kan hücreleri ve diğer biyolojik sistemler (kadife çiçeği kökleri gibi) tarafından üretilir. Ozon organik çift bağlarla doğrudan reaksiyona girer. Ayrıca, ozon dioksijene parçalandığında, oldukça reaktif olan ve birçok organik moleküle zarar verebilen serbest oksijen radikalleri ortaya çıkar. Dahası, ozonun güçlü oksitleyici özelliklerinin iltihaplanmaya katkıda bulunan bir faktör olabileceğine inanılmaktadır. Ozonun vücutta nasıl oluştuğu ve ne işe yaradığına dair neden-sonuç ilişkisi halen değerlendirilmekte olup, vücudun diğer kimyasal süreçleri de aynı reaksiyonlardan bazılarını tetikleyebildiğinden, halen çeşitli yorumlara tabidir. İnsan bağışıklık tepkisinin antikor katalizli su-oksidasyon yolunu ozon üretimine bağlayan kanıtlar vardır. Bu sistemde ozon, su ve nötrofil tarafından üretilen singlet oksijenden antikor katalizli trioksidan üretimi ile üretilir. ⓘ
Solunduğunda, ozon akciğerleri kaplayan bileşiklerle reaksiyona girerek aterosklerotik plakların (bir tür kalp hastalığı) oluşumunu ve patogenezini kolaylaştırdığı düşünülen spesifik, kolesterol türevi metabolitler oluşturur. Bu metabolitlerin insan aterosklerotik arterlerinde doğal olarak oluştuğu doğrulanmıştır ve aldolizasyon yoluyla ikincil bir yoğunlaşma ürününün yanı sıra bir 5,6 sekosterol oluşturmak için kolesterolün çift bağının ozonolizi ile üretilen atheronaller olarak adlandırılan bir sekosterol sınıfına kategorize edilir. ⓘ
Bitki büyümesi ve mahsul verimi üzerindeki etkisi
Ozonun bitki büyümesi üzerinde olumsuz bir etkisi olduğu tespit edilmiştir: "... ozon toplam klorofil, karotenoid ve karbonhidrat konsantrasyonunu azaltmış ve 1-aminosiklopropan-1-karboksilik asit (ACC) içeriğini ve etilen üretimini artırmıştır. Uygulama yapılan bitkilerde askorbat yaprak havuzu azalırken, lipid peroksidasyonu ve solüt sızıntısı ozon içermeyen kontrollere göre önemli ölçüde daha yüksekti. Veriler, ozonun turunçgillerde oksidatif strese karşı koruyucu mekanizmaları tetiklediğini göstermiştir." Biber bitkisini model olarak kullanan çalışmalar, ozonun meyve verimini azalttığını ve meyve kalitesini değiştirdiğini göstermiştir. Ayrıca, yapraklardaki klorofil seviyelerinde ve antioksidan savunmalarda azalmanın yanı sıra reaktif oksijen türleri (ROS) seviyelerinde ve lipid ve protein hasarlarında da artış gözlenmiştir. ⓘ
2022 yılında yapılan bir çalışma, fosil yakıtların yanmasının bir yan ürünü olan ozon kirliliği nedeniyle Doğu Asya'nın yılda 63 milyar Dolar ürün kaybettiği sonucuna varmıştır. Çin, potansiyel buğday üretiminin yaklaşık üçte birini ve pirinç üretiminin dörtte birini kaybetmektedir. ⓘ
Güvenlik düzenlemeleri
Ozonun güçlü oksitleyici özellikleri nedeniyle, ozon özellikle gözleri ve solunum sistemlerini etkileyen birincil tahriş edicidir ve düşük konsantrasyonlarda bile tehlikeli olabilir. Kanada İş Güvenliği ve Sağlığı Merkezi şunları bildirmektedir:
Çok düşük ozon konsantrasyonları bile üst solunum yolları ve akciğerler için zararlı olabilir. Yaralanmanın şiddeti hem ozon konsantrasyonuna hem de maruz kalma süresine bağlıdır. Nispeten düşük konsantrasyonlara çok kısa süreli maruziyet bile ciddi ve kalıcı akciğer hasarı veya ölümle sonuçlanabilir." ⓘ
ABD İş Güvenliği ve Sağlığı İdaresi, potansiyel olarak ozona maruz kalan çalışanları korumak için 8 saatlik zaman ağırlıklı ortalama olarak hesaplanan 0,1 μmol/mol (29 CFR 1910.1000 tablo Z-1) izin verilen maruz kalma sınırı (PEL) belirlemiştir. Daha yüksek konsantrasyonlar özellikle tehlikelidir ve NIOSH 5 μmol/mol Yaşam ve Sağlık İçin Hemen Tehlikeli Sınır (IDLH) belirlemiştir. Ozonun kullanıldığı veya üretilmesinin muhtemel olduğu çalışma ortamlarında yeterli havalandırma olmalıdır ve konsantrasyon OSHA PEL değerini aştığında alarm verecek bir ozon monitörü bulundurmak akıllıca olacaktır. Ozon için sürekli monitörler çeşitli tedarikçilerden temin edilebilir. ⓘ
Yolcu uçaklarında, irtifaya ve atmosferik türbülansa bağlı olarak yüksek ozon maruziyeti meydana gelebilir. Birleşik Devletler Federal Havacılık İdaresi düzenlemeleri, dört saatlik maksimum ortalama 100 nmol/mol olmak üzere 250 nmol/mol'lük bir sınır belirlemiştir. Bazı uçaklar, yolcuların maruziyetini azaltmak için havalandırma sisteminde ozon dönüştürücülerle donatılmıştır. ⓘ
Üretim

Ozon jeneratörleri veya ozonatörler, havayı temizlemek veya boş odalarda duman kokularını gidermek amacıyla ozon üretmek için kullanılır. Bu ozon jeneratörleri saatte 3 g'dan fazla ozon üretebilir. Ozon genellikle doğada O2'nin reaksiyona girmeyeceği koşullar altında oluşur. Endüstride kullanılan ozon μmol/mol (ppm, milyonda parça), nmol/mol (ppb, milyarda parça), μg/m3, mg/h (saatte miligram) veya ağırlık yüzdesi olarak ölçülür. Uygulanan konsantrasyonların rejimi, eski nesil yöntemler için %1 ila %5 (havada) ve %6 ila %14 (oksijende) arasında değişmektedir. Yeni elektrolitik yöntemler çıkış suyunda %20 ila %30 çözünmüş ozon konsantrasyonlarına ulaşabilmektedir. ⓘ
Sıcaklık ve nem, geleneksel üretim yöntemleri (korona deşarjı ve ultraviyole ışık gibi) kullanılarak ne kadar ozon üretildiği konusunda büyük rol oynar. Eski üretim yöntemleri, çok kuru havanın aksine nemli ortam havasıyla çalıştırılırsa nominal kapasitenin %50'sinden daha azını üretecektir. Elektrolitik yöntemler kullanan yeni jeneratörler, ozon üretim kaynağı olarak su moleküllerini kullanarak daha yüksek saflık ve çözünme elde edebilir. ⓘ
Koronal deşarj yöntemi

Bu, çoğu endüstriyel ve kişisel kullanım için en yaygın ozon jeneratörü türüdür. Tıbbi sınıf ve endüstriyel sınıf ozon jeneratörleri de dahil olmak üzere ozon üretiminin "sıcak kıvılcım" koronal deşarj yönteminin varyasyonları mevcut olsa da, bu üniteler genellikle bir korona deşarj tüpü veya ozon plakası aracılığıyla çalışır. Tipik olarak uygun maliyetlidirler ve %3-6'lık ozon konsantrasyonları üretmek için ortam havasından başka bir oksijen kaynağı gerektirmezler. Hava veya diğer çevresel koşullar nedeniyle ortam havasındaki dalgalanmalar ozon üretiminde değişkenliğe neden olur. Bununla birlikte, yan ürün olarak azot oksitleri de üretirler. Bir hava kurutucusunun kullanılması, su buharını gidererek nitrik asit oluşumunu azaltabilir veya ortadan kaldırabilir ve ozon üretimini artırabilir. Oda sıcaklığında nitrik asit, solunduğunda tehlikeli olan bir buhara dönüşecektir. Belirtiler arasında göğüs ağrısı, nefes darlığı, baş ağrısı ve yanma hissine neden olan kuru bir burun ve boğaz yer alabilir. Oksijen konsantratörü kullanımı ozon üretimini daha da artırabilir ve sadece su buharını değil aynı zamanda nitrojenin büyük kısmını da uzaklaştırarak nitrik asit oluşumu riskini daha da azaltabilir. ⓘ
Ultraviyole ışık
UV ozon jeneratörleri veya vakum-ultraviyole (VUV) ozon jeneratörleri, Güneş tarafından üretilenin bir alt kümesi olan dar bantlı bir ultraviyole ışık üreten bir ışık kaynağı kullanır. Güneş'in UV'si Dünya'nın stratosferindeki ozon tabakasını korur. ⓘ
UV ozon jeneratörleri ozon üretimi için ortam havasını kullanır, hava hazırlama sistemleri kullanılmaz (hava kurutucu veya oksijen konsantratörü), bu nedenle bu jeneratörler daha ucuz olma eğilimindedir. Bununla birlikte, UV ozon jeneratörleri genellikle yaklaşık %0,5 veya daha düşük konsantrasyonda ozon üretir ve bu da potansiyel ozon üretim oranını sınırlar. Bu yöntemin bir diğer dezavantajı da ortam havasının (oksijen) UV kaynağına daha uzun süre maruz kalmasını gerektirmesi ve UV kaynağına maruz kalmayan herhangi bir gazın arıtılmayacak olmasıdır. Bu durum, UV jeneratörlerini hızla hareket eden hava veya su akışlarının söz konusu olduğu durumlarda (örneğin kanal içi hava sterilizasyonu) kullanım için pratik olmaktan çıkarmaktadır. Ozon üretimi, ultraviyole mikrop öldürücü ışınlamanın potansiyel tehlikelerinden biridir. VUV ozon jeneratörleri, milyonlarca galon suya kadar değişen yüzme havuzları ve spa uygulamalarında kullanılır. VUV ozon jeneratörleri, korona deşarj jeneratörlerinin aksine, zararlı nitrojen yan ürünleri üretmez ve ayrıca korona deşarj sistemlerinin aksine, VUV ozon jeneratörleri nemli hava ortamlarında son derece iyi çalışır. Ayrıca normalde pahalı gaz çıkışı mekanizmalarına ve ekstra maliyet ve bakım gerektiren hava kurutuculara veya oksijen konsantratörlerine ihtiyaç yoktur. ⓘ
Soğuk plazma
Soğuk plazma yönteminde, saf oksijen gazı DBD tarafından oluşturulan bir plazmaya maruz bırakılır. Diatomik oksijen tek atomlara ayrılır ve bunlar daha sonra ozon oluşturmak için üçlüler halinde yeniden birleşir. Sektörde bazı DBD ozon jeneratörlerinin CD Korona Deşarj jeneratörleri olarak yanlış etiketlenmesi yaygındır. Tipik olarak tüm katı düz metal elektrotlu ozon jeneratörleri dielektrik bariyer deşarj yöntemini kullanarak ozon üretir. Soğuk plazma makineleri giriş kaynağı olarak saf oksijen kullanır ve maksimum yaklaşık %24 ozon konsantrasyonu üretir. Yaklaşık %2 verimliliğe sahip ultraviyole üretimine kıyasla belirli bir sürede çok daha fazla miktarda ozon üretirler. Deşarjlar, iki elektrot arasındaki bir boşlukta elektronların ipliksi transferi (mikro deşarjlar) olarak ortaya çıkar. Mikro deşarjları eşit olarak dağıtmak için, metalik elektrotları ayırmak ve ark oluşumunu önlemek amacıyla bir dielektrik yalıtkan kullanılmalıdır. ⓘ
Elektrolitik
Elektrolitik ozon üretimi (EOG) su moleküllerini H2, O2 ve O3'e ayırır. Çoğu EOG yönteminde, hidrojen gazı, oksijen ve ozonu tek reaksiyon ürünleri olarak bırakmak için çıkarılacaktır. Bu nedenle EOG, ortam havasında bulunan nitrojen gazları gibi korona deşarj yönteminde bulunan diğer rakip gazlar olmadan suda daha yüksek çözünme sağlayabilir. Bu üretim yöntemi %20-30'luk konsantrasyonlara ulaşabilir ve kaynak malzeme olarak su kullanıldığı için hava kalitesinden bağımsızdır. Ozonun elektrolitik olarak üretilmesi, oksijenle karşılaştırıldığında ozon üretmek için gereken yüksek aşırı potansiyel nedeniyle tipik olarak elverişsizdir. Bu nedenle tipik su elektrolizi sırasında ozon üretilmez. Bununla birlikte, ozonun tercihen elektroliz altında üretileceği şekilde dikkatli bir katalizör seçimi ile oksijenin aşırı potansiyelini artırmak mümkündür. Bu yaklaşım için tipik olarak seçilen katalizörler kurşun dioksit veya bor katkılı elmastır. ⓘ
Ozon/oksijen oranı, anottaki akım yoğunluğunun artırılması, anot etrafındaki elektrolitin 0 °C'ye yakın soğutulması, bazik bir çözelti yerine asidik bir elektrolit (seyreltik sülfürik asit gibi) kullanılması ve DC yerine darbeli akım uygulanmasıyla iyileştirilir. ⓘ
Özel hususlar
Ozon diğer endüstriyel gazlar gibi depolanamaz ve taşınamaz (çünkü hızla diyatomik oksijene dönüşür) ve bu nedenle sahada üretilmelidir. Mevcut ozon jeneratörleri, yüksek voltajlı elektrotların düzenlenmesi ve tasarımı açısından farklılık gösterir. Saatte 20 kg'dan daha yüksek üretim kapasitelerinde, zemin elektrodu olarak bir gaz/su borulu ısı eşanjörü kullanılabilir ve gaz tarafında boru şeklinde yüksek voltajlı elektrotlarla birleştirilebilir. Tipik gaz basınçları rejimi oksijende mutlak 2 bar (200 kPa) ve havada mutlak 3 bar (300 kPa) civarındadır. Büyük tesislerde, 50 ila 8000 Hz'de tek fazlı AC akımı ve 3.000 ila 20.000 volt arasında tepe gerilimleri olarak uygulanan birkaç megawatt elektrik gücü kurulabilir. Uygulanan voltaj genellikle uygulanan frekansla ters orantılıdır. ⓘ
Ozon üretim verimliliğini etkileyen baskın parametre, soğutma suyu sıcaklığı ve/veya gaz hızı ile kontrol edilen gaz sıcaklığıdır. Su ne kadar soğuk olursa ozon sentezi o kadar iyi olur. Gaz hızı ne kadar düşükse, konsantrasyon o kadar yüksek olur (ancak üretilen net ozon o kadar düşük olur). Tipik endüstriyel koşullarda, etkin gücün neredeyse %90'ı ısı olarak dağılır ve yeterli bir soğutma suyu akışı ile uzaklaştırılması gerekir. ⓘ
Ozonun yüksek reaktivitesi nedeniyle, paslanmaz çelik (316L kalite), titanyum, alüminyum (nem olmadığı sürece), cam, politetrafloretilen veya poliviniliden florür gibi sadece birkaç malzeme kullanılabilir. Viton, sabit mekanik kuvvetler ve nem olmaması kısıtlamasıyla kullanılabilir (formülasyona bağlı olarak nem sınırlamaları geçerlidir). Hypalon, normal atmosferik seviyeler dışında su ile temas etmemesi şartıyla kullanılabilir. Gevrekleşme veya büzülme, elastomerlerin ozona maruz kaldığında yaygın olarak görülen başarısızlık modudur. Ozon çatlaması, O-ringler gibi elastomer contaların yaygın arıza modudur. ⓘ
Silikon kauçuklar, kauçuk numunelerin hızlandırılmış yaşlandırma ekipmanlarında olduğu gibi, ağırlıkça %1'in altındaki ozon konsantrasyonlarında conta olarak kullanım için genellikle yeterlidir. ⓘ
Tesadüfi üretim
Ozon O'dan oluşabilir
2 elektrik deşarjları ve yüksek enerjili elektromanyetik radyasyonun etkisiyle. Elektrik kontaklarındaki, motor fırçalarındaki veya mekanik anahtarlardaki bastırılmamış ark, kontakları çevreleyen atmosferik oksijenin kimyasal bağlarını [O
2 → 2O]. Ark içinde ve çevresinde serbest oksijen radikalleri yeniden birleşerek ozon [O
3]. Bazı elektrikli ekipmanlar önemli seviyelerde ozon üretir. Bu durum özellikle iyonik hava temizleyicileri, lazer yazıcılar, fotokopi makineleri, şok cihazları ve ark kaynakçıları gibi yüksek voltaj kullanan cihazlar için geçerlidir. Fırça kullanan elektrik motorları, ünite içinde tekrarlanan kıvılcımlar nedeniyle ozon üretebilir. Asansörler veya hidrolik pompalar tarafından kullanılanlar gibi fırça kullanan büyük motorlar, küçük motorlardan daha fazla ozon üretecektir. ⓘ
Ozon benzer şekilde Venezuela'daki Catatumbo Nehri'nde meydana gelen Catatumbo şimşek fırtınalarında da oluşur, ancak ozonun kararsızlığı ozonosfer üzerinde herhangi bir etkiye sahip olduğunu şüpheli hale getirir. Dünyanın en büyük tek doğal ozon jeneratörüdür ve UNESCO Dünya Mirası Listesi'ne alınması için çağrıda bulunmaktadır. ⓘ
Laboratuvar üretimi

Laboratuvarda ozon, 9 voltluk bir pil, bir kalem grafit çubuk katot, bir platin tel anot ve 3 molar sülfürik asit elektrolit kullanılarak elektroliz yoluyla üretilebilir. Gerçekleşen yarı hücre reaksiyonları şunlardır:
- 3 H2O → O3 + 6 H+ + 6 e- (ΔE° = -1,53 V)
- 6 H+ + 6 e- → 3 H2 (ΔE° = 0 V)
- 2 H2O → O2 + 4 H+ + 4 e- (ΔE° = 1,23 V) ⓘ
Net reaksiyonda, üç eşdeğer su bir eşdeğer ozon ve üç eşdeğer hidrojene dönüşür. Oksijen oluşumu rakip bir reaksiyondur. ⓘ
Yüksek voltajlı bir ark tarafından da üretilebilir. En basit haliyle, bir neon tabela transformatörünün çıkışı gibi yüksek voltajlı AC, uçları bir ark oluşturacak şekilde birbirine yeterince yakın yerleştirilmiş iki metal çubuğa bağlanır. Oluşan ark atmosferik oksijeni ozona dönüştürecektir. ⓘ
Genellikle ozonun kontrol altına alınması istenir. Bu, dış tüpün üstünde ve altında gaz portları bulunan, üstten birbirine kapatılmış iki eşmerkezli cam tüpten oluşan bir aparatla yapılabilir. İç çekirdek, güç kaynağının bir tarafına bağlı olarak içine yerleştirilmiş bir metal folyo uzunluğuna sahip olmalıdır. Güç kaynağının diğer tarafı, dış tüpün etrafına sarılmış başka bir folyo parçasına bağlanmalıdır. Bir kuru O
2 alt porta uygulanır. Folyo uçlarına yüksek voltaj uygulandığında, elektrik ortadaki kuru dioksijen arasında boşalacak ve O
3 ve O
2 üst porttan dışarı akacaktır. Buna Siemen ozonizörü denir. Reaksiyon aşağıdaki gibi özetlenebilir:
- Ayrıştırılamadı (MathML, SVG ya da PNG geri dönüş (modern tarayıcılar ve erişilebilirlik araçları için önerilir): Geçersiz yanıt ("Math extension cannot connect to Restbase.") sunucu "https://wikimedia.org/api/rest_v1/":): {\displaystyle \ce{3O2 ->[elektrik] 2O3 <span title="Kaynak: İngilizce Vikipedi, Bölüm "Laboratory production"" class="plainlinks">[https://en.wikipedia.org/wiki/Ozone#Laboratory_production <span style="color:#dddddd">ⓘ</span>]</span>}}
Uygulamalar
Endüstri
Ozonun en büyük kullanım alanı, karbon-karbon bağlarını koparmak için kullanıldığı farmasötiklerin, sentetik yağlayıcıların ve ticari olarak yararlı diğer birçok organik bileşiğin hazırlanmasıdır. Ayrıca maddelerin ağartılması ve hava ve su kaynaklarındaki mikroorganizmaların öldürülmesi için de kullanılabilir. Birçok belediye içme suyu sistemi, bakterileri daha yaygın olan klor yerine ozonla öldürmektedir. Ozonun çok yüksek bir oksidasyon potansiyeli vardır. Ozon organoklor bileşikleri oluşturmaz ve arıtmadan sonra suda kalmaz. Ozon, yüksek bromür konsantrasyonlarına sahip kaynak sularında şüpheli kanserojen bromat oluşturabilir. ABD Güvenli İçme Suyu Yasası, bu sistemlerin düzenli test sonuçlarına göre borularda minimum 0,2 μmol/mol serbest klor kalıntısını koruyacak miktarda klor eklemesini zorunlu kılmaktadır. Elektrik enerjisinin bol olduğu yerlerde ozon, talep üzerine üretildiği ve tehlikeli kimyasalların taşınmasını ve depolanmasını gerektirmediği için suyun arıtılmasında uygun maliyetli bir yöntemdir. Çürüdükten sonra içme suyunda hiçbir tat veya koku bırakmaz. ⓘ
Her ne kadar düşük seviyelerde ozonun konutlarda dezenfektan olarak kullanılabileceği söylense de, havadaki patojenler üzerinde hızlı ve önemli bir etkiye sahip olmak için gereken kuru havadaki ozon konsantrasyonu, ABD Mesleki Güvenlik ve Sağlık İdaresi ve Çevre Koruma Ajansı tarafından önerilen güvenli seviyeleri aşmaktadır. Nem kontrolü hem ozonun öldürme gücünü hem de oksijene dönüşme hızını büyük ölçüde artırabilir (daha fazla nem daha fazla etkinlik sağlar). Çoğu patojenin spor formları, astım hastalarının sorun yaşamaya başladığı konsantrasyonlarda atmosferik ozona karşı çok toleranslıdır. ⓘ
1908 yılında Londra Metrosu'nun Merkez Hattı'nda yapay ozonlama, havadan dezenfektan olarak kullanılmaya başlandı. Sürecin faydalı olduğu görülmüş ancak 1956 yılında aşamalı olarak kaldırılmıştır. Ancak faydalı etki, tren motorlarının elektrik deşarjlarından tesadüfen oluşan ozon sayesinde devam etmiştir (yukarıya bakınız: Tesadüfi üretim). ⓘ
Ozon jeneratörleri, COVID-19 salgınlarından sonra sınıfları dezenfekte etmek için 2021 Sonbahar döneminde Galler'deki okul ve üniversitelerin kullanımına sunuldu. ⓘ
Endüstriyel olarak ozon şunlar için kullanılır
- Hastanelerde, gıda fabrikalarında, bakım evlerinde vb. çamaşırları dezenfekte etmek;
- Klor yerine suyu dezenfekte etmek
- Yangın sonrası gibi hava ve nesnelerin kokusunu giderir. Bu işlem kumaş restorasyonunda yaygın olarak kullanılır
- Gıda üzerindeki veya temas yüzeylerindeki bakterileri öldürür;
- Bira fabrikaları ve süt ürünleri tesisleri gibi su yoğun endüstriler, perasetik asit, hipoklorit veya ısı gibi kimyasal dezenfektanların yerine çözünmüş ozonu etkili bir şekilde kullanabilir.
- Soğutma kulelerini dezenfekte edin ve daha az kimyasal tüketimi, su tahliyesi ve artan performans ile Lejyonella'yı kontrol edin.
- Yüzme havuzlarını ve kaplıcaları sterilize edin
- Depolanmış tahıldaki böcekleri öldürür
- Gıda işleme tesislerinde havadaki maya ve küf sporlarını temizleyin;
- Maya, küf ve bakterileri öldürmek için taze meyve ve sebzeleri yıkayın;
- Sudaki kirleticilere kimyasal olarak saldırır (demir, arsenik, hidrojen sülfür, nitritler ve "renk" olarak bir araya getirilmiş karmaşık organikler);
- Flokülasyona yardımcı olur (demir ve arseniğin giderildiği filtrasyona yardımcı olan moleküllerin toplanması);
- Kimyasal sentez yoluyla kimyasal bileşiklerin üretilmesi
- Kumaşları temizler ve ağartır (ilk kullanım kumaş restorasyonunda kullanılır; ikinci kullanım patentlidir);
- Klor bazlı ağartmada antiklor görevi görür;
- Mürekkeplerin yapışmasını sağlamak için plastiklerin işlenmesine yardımcı olur;
- Bir kauçuk partisinin faydalı ömrünü belirlemek için kauçuk örneklerini yaşlandırmak;
- Yüzey suyu arıtma tesislerinde Giardia lamblia ve Cryptosporidium gibi su kaynaklı parazitlerin yok edilmesi. ⓘ
Ozon, laboratuvarda ve endüstride birçok organik reaksiyonda bir reaktiftir. Ozonoliz, bir alkenin karbonil bileşiklerine ayrılmasıdır. ⓘ
Dünyadaki birçok hastane, ameliyatlar arasında ameliyathaneleri dekontamine etmek için büyük ozon jeneratörleri kullanmaktadır. Odalar temizlenir ve ardından kalan tüm bakterileri etkili bir şekilde öldüren veya nötralize eden ozonla doldurulmadan önce hava geçirmez şekilde kapatılır. ⓘ
Ozon, odun hamurunun ağartılmasında klor veya klor dioksite alternatif olarak kullanılır. Yüksek kaliteli, beyaz kağıt üretiminde klor içeren bileşiklere olan ihtiyacı ortadan kaldırmak için genellikle oksijen ve hidrojen peroksit ile birlikte kullanılır. ⓘ
Ozon, siyanürü siyanata ve nihayetinde karbondioksite oksitleyerek siyanür atıklarını (örneğin altın ve gümüş madenciliğinden kaynaklanan) detoksifiye etmek için kullanılabilir. ⓘ
Su dezenfeksiyonu
Dielektrik Bariyer Deşarj (DBD) plazma reaktörlerinin icadından bu yana, ozon ile su arıtımı için kullanılmaktadır. Bununla birlikte, klor gibi daha ucuz alternatif dezenfektanlarla, DBD ozon su dekontaminasyonunun bu tür uygulamaları yüksek güç tüketimi ve hantal ekipmanlarla sınırlandırılmıştır. Buna rağmen, klor gibi yaygın dezenfektanların toksik kalıntılar ve belirli mikroorganizmaları öldürmedeki etkisizliği açısından olumsuz etkilerini ortaya koyan araştırmalarla, DBD plazma bazlı ozon dekontaminasyonu mevcut mevcut teknolojiler arasında ilgi çekmektedir. Yüksek konsantrasyonda bromür içeren suyun ozonlanması istenmeyen bromlu dezenfeksiyon yan ürünlerinin oluşmasına yol açsa da, içme suyu tuzdan arındırma yoluyla üretilmediği sürece, ozonlama genellikle bu yan ürünler için endişe duyulmadan uygulanabilir. Ozonun avantajları arasında yüksek termodinamik oksidasyon potansiyeli, organik maddelere karşı daha az hassasiyet ve bakteri, mantar, virüs, spor ve kistleri öldürme kabiliyetini korurken pH değişimlerine karşı daha iyi tolerans bulunmaktadır. Ozon, Avrupa'da on yıllardır yaygın olarak kabul görmesine rağmen, yüksek güç tüketimi, hantal kurulum ve ozon toksisitesine bağlı damgalama sınırlamaları nedeniyle ABD'de dekontaminasyon için nadiren kullanılmaktadır. Bu durum göz önünde bulundurularak, son zamanlardaki araştırma çabaları etkili ozon su arıtma sistemlerinin incelenmesine yönlendirilmiştir Araştırmacılar hafif ve kompakt düşük güçlü yüzey DBD reaktörlerini, enerji verimli hacim DBD reaktörlerini ve düşük güçlü mikro ölçekli DBD reaktörlerini incelemişlerdir. Bu tür çalışmalar, özellikle ABD'de suyun DBD plazma bazlı ozon dekontaminasyonunun yeniden kabul edilmesine giden yolu açmaya yardımcı olabilir. ⓘ
Tüketiciler
Bazıları iyonizasyon kullanan yüksek düzeyde ozon üreten cihazlar, oturulmayan binaları, odaları, kanalları, odunlukları, tekneleri ve diğer araçları sterilize etmek ve kokularını gidermek için kullanılır. ⓘ
Ozonlanmış su, çamaşır yıkamak ve evdeki yiyecekleri, içme suyunu ve yüzeyleri sterilize etmek için kullanılır. ABD Gıda ve İlaç Dairesi'ne (FDA) göre, "et ve kümes hayvanları da dahil olmak üzere gıdalarda antimikrobiyal bir madde olarak gaz ve sulu fazlarda ozonun güvenli kullanımını sağlamak için gıda katkı maddesi yönetmeliklerini değiştiriyor." California Polytechnic Üniversitesi'nde yapılan çalışmalar, filtrelenmiş musluk suyunda çözünen 0,3 μmol/mol seviyesindeki ozonun salmonella, E. coli 0157:H7 ve Campylobacter gibi gıda kaynaklı mikroorganizmalarda %99,99'dan fazla bir azalma sağlayabildiğini göstermiştir. Bu miktar, yukarıda belirtilen WHO tarafından önerilen limitlerin 20.000 katıdır. Ozon, meyve ve sebzelerdeki pestisit kalıntılarını gidermek için kullanılabilir. ⓘ
Ozon, evlerde ve jakuzilerde sudaki bakterileri öldürmek ve onları serbest hallerine yeniden aktive ederek gerekli klor veya brom miktarını azaltmak için kullanılır. Ozon suda yeterince uzun süre kalmadığından, ozon tek başına banyo yapanlar arasında çapraz kontaminasyonu önlemede etkisizdir ve halojenlerle birlikte kullanılmalıdır. Ultraviyole ışık veya korona deşarjı ile oluşturulan gaz halindeki ozon suya enjekte edilir. ⓘ
Ozon ayrıca akvaryum ve balık havuzlarındaki suyun arıtılmasında da yaygın olarak kullanılmaktadır. Kullanımı bakteriyel büyümeyi en aza indirebilir, parazitleri kontrol edebilir, bazı hastalıkların bulaşmasını önleyebilir ve suyun "sararmasını" azaltabilir veya ortadan kaldırabilir. Ozon balıkların solungaç yapıları ile temas etmemelidir. Doğal tuzlu su (yaşam formlarıyla birlikte), kontrollü miktarlarda ozonun bromür iyonlarını hipobromöz aside aktive etmesi için yeterli "anlık talep" sağlar ve ozon birkaç saniye ila dakika içinde tamamen bozulur. Oksijenle beslenen ozon kullanılırsa, suyun çözünmüş oksijen oranı daha yüksek olacak ve balıkların solungaç yapıları körelecek, bu da onları oksijenle zenginleştirilmiş suya bağımlı hale getirecektir. ⓘ
Akuakültür
Ozonlama - suyun ozonla aşılanması işlemi - organik parçalanmayı kolaylaştırmak için akuakültürde kullanılabilir. Ozon ayrıca nitrite dönüşerek nitrit seviyelerini düşürmek için devridaim sistemlerine de eklenir. Sudaki nitrit seviyeleri yüksekse, nitritler balıkların kanında ve dokularında da birikir ve burada oksijen taşınmasını engeller (hemoglobinin hem grubunun demirden oksidasyonuna neden olur (Fe2+
) ferrik (Fe3+
), hemoglobini O'yu bağlayamaz hale getirir.
2). Bu belirgin olumlu etkilere rağmen, devridaim sistemlerinde ozon kullanımı, tuzlu su sistemlerinde biyolojik olarak kullanılabilir iyot seviyesini azaltarak guatr gibi iyot eksikliği semptomlarına ve Senegal dil balığı (Solea senegalensis) larvalarında büyümenin azalmasına neden olmuştur. ⓘ
Ozonatlı deniz suyu, mezgit ve Atlantik pisi balığı yumurtalarının nodavirüse karşı yüzey dezenfeksiyonu için kullanılır. Nodavirus, balıklarda ciddi ölümlere neden olan ölümcül ve dikey olarak bulaşan bir virüstür. Mezgit yumurtaları yüksek ozon seviyesi ile muamele edilmemelidir çünkü bu şekilde muamele edilen yumurtalar çatlamaz ve 3-4 gün sonra ölür. ⓘ
Tarım
Taze kesilmiş ananas ve muza ozon uygulanması, 20 dakikaya kadar maruz kalındığında flavonoid ve toplam fenol içeriğinde artış göstermektedir. Askorbik asit (C vitamininin bir formu) içeriğinde azalma gözlenir, ancak toplam fenol içeriği ve flavonoidler üzerindeki olumlu etki olumsuz etkinin üstesinden gelebilir. Domatesler ozon ile muamele edildikten sonra β-karoten, lutein ve likopende artış gösterir. Bununla birlikte, hasat öncesi dönemde çileklere ozon uygulanması askorbik asit içeriğinde azalma göstermektedir. ⓘ
Ozon, EDTA kullanarak bazı ağır metallerin topraktan ekstraksiyonunu kolaylaştırır. EDTA bazı ağır metallerle (Pb, Zn) güçlü, suda çözünebilen koordinasyon bileşikleri oluşturarak bu metallerin kirlenmiş topraktan çözünmesini mümkün kılar. Kirlenmiş toprak ozon ile ön işleme tabi tutulursa, Pb, Am ve Pu'nun ekstraksiyon etkinliği sırasıyla %11,0-28,9, %43,5 ve %50,7 oranında artar. ⓘ
Alternatif tıp
Tıbbi durumların tedavisi için ozon kullanımı yüksek kaliteli kanıtlarla desteklenmemektedir ve genellikle alternatif tıp olarak kabul edilmektedir. ⓘ








![{\displaystyle K_{1}={K_{1} \over K_{-1}}={[O_{2}]\cdot [O] \over [O_{3}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/790e2ee894cf7ce231dd072be28e6e51e8340ac6)
![{\displaystyle [O]={K_{1}\cdot [O_{3}] \over K_{-1}\cdot [O_{2}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e2379ad127a03a4bf3ca94183a20b5fa3fc00e11)
![{\displaystyle V={2K_{2}\cdot K_{1}\cdot [O_{3}]^{2} \over K_{-1}\cdot [O_{2}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d1395af6c802f7969c8c5d37d0a2a5cc4b9cd371)
![{\displaystyle V={K_{obs}\cdot [O_{3}]^{2} \over [O_{2}]}=K_{obs}\cdot [O_{3}]^{2}\cdot [O_{2}]^{-1}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/66b7f62c5f8599754ba525ce4adf754150878cf8)

![{\displaystyle {\ce {O2->[{\ce {foton}}][({\ce {radyasyon}}\ \lambda \ <\ 240\ {\ce {nm}})]2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/19db079ea1ac42a76f85561619a66ef8f704a4c0)
