Demir
 | |||||||||||||||||||||||||||||||||||||||||
| Demir | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allotroplar | bkz. demir allotropları | ||||||||||||||||||||||||||||||||||||||||
| Görünüş | grimsi bir renk tonu ile parlak metalik | ||||||||||||||||||||||||||||||||||||||||
| Standart atom ağırlığı Ar°(Fe) |
| ||||||||||||||||||||||||||||||||||||||||
| Periyodik tabloda demir | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| Atom numarası (Z) | 26 | ||||||||||||||||||||||||||||||||||||||||
| Grup | Grup 8 | ||||||||||||||||||||||||||||||||||||||||
| Dönem | dönem 4 | ||||||||||||||||||||||||||||||||||||||||
| Blok | d-blok | ||||||||||||||||||||||||||||||||||||||||
| Elektron konfigürasyonu | [[[Argon|Ar]]] 3d6 4s2 | ||||||||||||||||||||||||||||||||||||||||
| Kabuk başına elektron | 2, 8, 14, 2 | ||||||||||||||||||||||||||||||||||||||||
| Fiziksel özellikler | |||||||||||||||||||||||||||||||||||||||||
| STP'de Faz | katı | ||||||||||||||||||||||||||||||||||||||||
| Erime noktası | 1811 K (1538 °C, 2800 °F) | ||||||||||||||||||||||||||||||||||||||||
| Kaynama noktası | 3134 K (2862 °C, 5182 °F) | ||||||||||||||||||||||||||||||||||||||||
| Yoğunluk (r.t.'ye yakın) | 7.874 g/cm3 | ||||||||||||||||||||||||||||||||||||||||
| sıvı olduğunda (m.p.'de) | 6,98 g/cm3 | ||||||||||||||||||||||||||||||||||||||||
| Füzyon ısısı | 13,81 kJ/mol | ||||||||||||||||||||||||||||||||||||||||
| Buharlaşma ısısı | 340 kJ/mol | ||||||||||||||||||||||||||||||||||||||||
| Molar ısı kapasitesi | 25,10 J/(mol-K) | ||||||||||||||||||||||||||||||||||||||||
Buhar basıncı
| |||||||||||||||||||||||||||||||||||||||||
| Atomik özellikler | |||||||||||||||||||||||||||||||||||||||||
| Oksidasyon durumları | -4, -2, -1, 0, +1, +2, +3, +4, +5, +6, +7 (bir amfoterik oksit) | ||||||||||||||||||||||||||||||||||||||||
| Elektronegatiflik | Pauling ölçeği: 1.83 | ||||||||||||||||||||||||||||||||||||||||
| İyonlaşma enerjileri |
| ||||||||||||||||||||||||||||||||||||||||
| Atomik yarıçap | ampi̇ri̇k: 126 pm | ||||||||||||||||||||||||||||||||||||||||
| Kovalent yarıçap | Düşük dönüş: 132±3 pm Yüksek dönüş: 152±6 pm | ||||||||||||||||||||||||||||||||||||||||
| Van der Waals yarıçapı | 194 [1] pm | ||||||||||||||||||||||||||||||||||||||||
| Demirin spektral çizgileri | |||||||||||||||||||||||||||||||||||||||||
| Diğer özellikler | |||||||||||||||||||||||||||||||||||||||||
| Doğal oluşum | ilkel | ||||||||||||||||||||||||||||||||||||||||
| Kristal yapı | gövde merkezli kübik (bcc) a=286.65 pm | ||||||||||||||||||||||||||||||||||||||||
| Kristal yapı | yüz merkezli kübik (fcc) 1185-1667 K arasında; a=364.680 pm | ||||||||||||||||||||||||||||||||||||||||
| Ses hızı ince çubuk | 5120 m/s (r.t.'de) (elektrolitik) | ||||||||||||||||||||||||||||||||||||||||
| Termal genleşme | 11,8 µm/(m⋅K) (25 °C'de) | ||||||||||||||||||||||||||||||||||||||||
| Termal iletkenlik | 80,4 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||
| Elektriksel direnç | 96,1 nΩ⋅m (20 °C'de) | ||||||||||||||||||||||||||||||||||||||||
| Curie noktası | 1043 K | ||||||||||||||||||||||||||||||||||||||||
| Manyetik sıralama | ferromanyetik | ||||||||||||||||||||||||||||||||||||||||
| Young modülü | 211 GPa | ||||||||||||||||||||||||||||||||||||||||
| Kayma modülü | 82 GPa | ||||||||||||||||||||||||||||||||||||||||
| Yığın modülü | 170 GPa | ||||||||||||||||||||||||||||||||||||||||
| Poisson oranı | 0.29 | ||||||||||||||||||||||||||||||||||||||||
| Mohs sertliği | 4 | ||||||||||||||||||||||||||||||||||||||||
| Vickers sertliği | 608 MPa | ||||||||||||||||||||||||||||||||||||||||
| Brinell sertliği | 200-1180 MPa | ||||||||||||||||||||||||||||||||||||||||
| CAS Numarası | 7439-89-6 | ||||||||||||||||||||||||||||||||||||||||
| Tarih | |||||||||||||||||||||||||||||||||||||||||
| Keşif | MÖ 5000'den önce | ||||||||||||||||||||||||||||||||||||||||
| Sembol | "Fe": Latince ferrum'dan | ||||||||||||||||||||||||||||||||||||||||
| Demirin ana izotopları | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
Demir (/ˈaɪərn/), sembolü Fe (Latince: ferrum) ve atom numarası 26 olan kimyasal bir elementtir. Periyodik tablonun ilk geçiş serisine ve 8. grubuna ait bir metaldir. Kütle olarak, oksijenin hemen önünde (sırasıyla %32,1 ve %30,1) Dünya'daki en yaygın elementtir ve Dünya'nın dış ve iç çekirdeğinin çoğunu oluşturur. Dünya'nın kabuğunda en yaygın dördüncü elementtir. ⓘ
Metalik haliyle demir, Dünya'nın kabuğunda nadirdir ve esas olarak meteorlar tarafından biriktirilmesiyle sınırlıdır. Buna karşın demir cevherleri yerkabuğunda en bol bulunanlar arasındadır, ancak bunlardan kullanılabilir metal elde etmek için 1.500 °C (2.730 °F) veya daha yüksek sıcaklıklara (bakırın eritilmesi için gerekenden yaklaşık 500 °C (932 °F) daha yüksek) ulaşabilen fırınlar veya ocaklar gerekir. İnsanlar bu süreçte Avrasya'da M.Ö. 2. binyılda ustalaşmaya başlamış ve demir alet ve silahların kullanımı bazı bölgelerde ancak M.Ö. 1200 civarında bakır alaşımlarının yerini almaya başlamıştır. Bu olay Bronz Çağı'ndan Demir Çağı'na geçiş olarak kabul edilir. Modern dünyada çelik, paslanmaz çelik, dökme demir ve özel çelikler gibi demir alaşımları, mekanik özellikleri ve düşük maliyetleri nedeniyle açık ara en yaygın endüstriyel metallerdir. Demir ve çelik endüstrisi bu nedenle ekonomik açıdan çok önemlidir ve demir, kilogram veya pound başına birkaç dolarlık fiyatıyla en ucuz metaldir (bkz. Metal#kullanımları). ⓘ
Bozulmamış ve pürüzsüz saf demir yüzeyleri ayna gibi gümüşi gridir. Ancak demir, oksijen ve suyla kolayca reaksiyona girerek yaygın olarak pas olarak bilinen kahverengi ila siyah hidratlı demir oksitleri verir. Pas, pasifleştirici katmanlar oluşturan diğer bazı metallerin oksitlerinin aksine, metalden daha fazla hacim kaplar ve böylece korozyon için yeni yüzeyler ortaya çıkararak pul pul dökülür. Demir kolayca reaksiyona girse de, elektrolitik demir olarak adlandırılan yüksek saflıktaki demir daha iyi korozyon direncine sahiptir. ⓘ
Yetişkin bir insanın vücudu, çoğunlukla hemoglobin ve miyoglobinde olmak üzere yaklaşık 4 gram (vücut ağırlığının %0,005'i) demir içerir. Bu iki protein, omurgalı metabolizmasında sırasıyla kan yoluyla oksijen taşınması ve kaslarda oksijen depolanması gibi temel roller oynar. Gerekli seviyeleri korumak için, insan demir metabolizması diyette minimum demir gerektirir. Demir aynı zamanda bitki ve hayvanlarda hücresel solunum, oksidasyon ve redüksiyon ile ilgili birçok önemli redoks enziminin aktif bölgesindeki metaldir. ⓘ
Kimyasal olarak demirin en yaygın oksidasyon durumları demir(II) ve demir(III)'tür. Demir, diğer 8. grup elementleri olan rutenyum ve osmiyum da dahil olmak üzere diğer geçiş metallerinin birçok özelliğini paylaşır. Demir, -2 ila +7 gibi geniş bir oksidasyon durumu aralığında bileşikler oluşturur. Demir ayrıca birçok koordinasyon bileşiği oluşturur; ferrosen, ferrioksalat ve Prusya mavisi gibi bazılarının önemli endüstriyel, tıbbi veya araştırma uygulamaları vardır. ⓘ

Demir, dünya yüzeyinde en yaygın dördüncü mineral ve yerkabuğunda en çok bulunan metaldir. Yerkürenin merkezindeki sıvı çekirdeğin de tek bir demir kristali olduğu tahmin edilmekle birlikte, demir nikel alaşımı olma ihtimali daha yüksektir. Dünyanın merkezindeki bu kadar yüksek miktardaki yoğun demir kütlesinin dünyanın manyetik alanına etki ettiği düşünülmektedir. ⓘ
Demir, karbonla birlikte 1420–1470 K sıcaklığa kadar ısıtıldığında oluşan sıvı eriyik %96,5 demir ve %3,5 karbon içeren bir alaşımdır ve dökme demir veya pik olarak adlandırılır. Bu ürün ince detaylı şekiller halinde dökülebilirse de, içerdiği karbonun çoğunu uzaklaştırmak amacıyla dekarbürize edilmediği sürece, işlenebilmek için fazlasıyla kırılgandır. ⓘ
Özellikleri
Allotroplar

Geleneksel olarak α, γ, δ ve ε olarak adlandırılan en az dört demir allotropu (katıdaki farklı atom düzenlemeleri) bilinmektedir. ⓘ

İlk üç form normal basınçlarda gözlemlenir. Erimiş demir, donma noktası olan 1538 °C'nin ötesinde soğudukça, gövde merkezli kübik (bcc) kristal yapıya sahip olan δ allotropuna kristalleşir. Daha sonra 1394 °C'ye kadar soğuyunca, yüz merkezli kübik (fcc) kristal yapıya sahip γ-demir allotropuna veya östenite dönüşür. 912 °C ve altında kristal yapı tekrar bcc α-demir allotropuna dönüşür. ⓘ
Demirin çok yüksek basınç ve sıcaklıklardaki fiziksel özellikleri de, Dünya ve diğer gezegenlerin çekirdekleri hakkındaki teorilerle olan ilgileri nedeniyle kapsamlı bir şekilde incelenmiştir. Yaklaşık 10 GPa'nın üzerinde ve birkaç yüz kelvin veya daha düşük sıcaklıklarda α-demir, ε-demir olarak da bilinen başka bir altıgen yakın paketlenmiş (hcp) yapıya dönüşür. Daha yüksek sıcaklıktaki γ-fazı da ε-demirine dönüşür, ancak bunu daha yüksek basınçta yapar. ⓘ
Ortorombik veya çift hcp yapısına sahip olduğu varsayılan 50 GPa'nın üzerindeki basınçlarda ve en az 1500 K sıcaklıklarda kararlı bir β fazı için bazı tartışmalı deneysel kanıtlar mevcuttur. (Kafa karıştırıcı bir şekilde, "β-demir" terimi bazen kristal yapısı değişmemiş olsa da ferromanyetikten paramanyetiğe dönüştüğü Curie noktasının üzerindeki α-demiri ifade etmek için de kullanılır). ⓘ
Dünya'nın iç çekirdeğinin genellikle ε (veya β) yapısına sahip bir demir-nikel alaşımından oluştuğu varsayılmaktadır. ⓘ
Erime ve kaynama noktaları
Demirin erime ve kaynama noktaları, atomlaşma entalpisi ile birlikte, skandiyumdan kroma kadar önceki 3 boyutlu elementlerinkinden daha düşüktür, bu da 3 boyutlu elektronların çekirdek tarafından inert çekirdeğe daha fazla çekildikçe metalik bağa katkısının azaldığını gösterir; ancak, önceki element manganezin değerlerinden daha yüksektir, çünkü bu element yarı dolu bir 3 boyutlu alt kabuğa sahiptir ve sonuç olarak d-elektronları kolayca delokalize olmaz. Aynı eğilim rutenyum için de geçerlidir ancak osmiyum için geçerli değildir. ⓘ
Demirin erime noktası 50 GPa'dan daha düşük basınçlar için deneysel olarak iyi tanımlanmıştır. Daha yüksek basınçlar için, yayınlanmış veriler (2007 itibariyle) hala onlarca gigapaskal ve binin üzerinde kelvin ile değişmektedir. ⓘ
Manyetik özellikler

Curie noktası olan 770 °C'nin (1,420 °F; 1,040 K) altında α-demir paramanyetikten ferromanyetiğe dönüşür: her atomdaki iki eşleşmemiş elektronun spinleri genellikle komşularının spinleriyle hizalanarak genel bir manyetik alan oluşturur. Bunun nedeni, bu iki elektronun (dz2 ve dx2 - y2) orbitallerinin kafesteki komşu atomlara doğru bakmaması ve bu nedenle metalik bağlanmaya dahil olmamasıdır. ⓘ
Harici bir manyetik alan kaynağının yokluğunda, atomlar kendiliğinden yaklaşık 10 mikrometre genişliğinde manyetik alanlara bölünür, öyle ki her alandaki atomlar paralel spinlere sahiptir, ancak bazı alanlar farklı yönelimlere sahiptir. Böylece makroskopik bir demir parçası neredeyse sıfır genel manyetik alana sahip olacaktır. ⓘ
Harici bir manyetik alanın uygulanması, aynı genel yönde manyetize olan alanların, diğer yönleri işaret eden bitişik alanların pahasına büyümesine neden olarak harici alanı güçlendirir. Bu etki, elektrik transformatörleri, manyetik kayıt kafaları ve elektrik motorları gibi tasarım işlevini yerine getirmek için manyetik alanları yönlendirmesi gereken cihazlarda kullanılır. Safsızlıklar, kafes kusurları veya tane ve parçacık sınırları, alanları yeni konumlara "sabitleyebilir", böylece etki dış alan kaldırıldıktan sonra bile devam eder - böylece demir nesneyi (kalıcı) bir mıknatısa dönüştürür. ⓘ
Benzer davranış, karışık demir (II,III) oksit Fe3O4'ün kristal bir formu olan mineral manyetit dahil ferritler gibi bazı demir bileşikleri tarafından sergilenir (atomik ölçekli mekanizma, ferrimanyetizma, biraz farklı olsa da). Doğal kalıcı mıknatıslanma özelliğine sahip manyetit parçaları (lodestonlar) navigasyon için en eski pusulaları sağlamıştır. Manyetit parçacıkları, kobalt bazlı malzemelerle değiştirilene kadar çekirdek bellekler, manyetik bantlar, disketler ve diskler gibi manyetik kayıt ortamlarında yaygın olarak kullanılmıştır. ⓘ
İzotoplar
Demirin dört kararlı izotopu vardır: 54Fe (doğal demirin %5,845'i), 56Fe (%91,754), 57Fe (%2,119) ve 58Fe (%0,282). 20-30 yapay izotop da yaratılmıştır. Bu kararlı izotoplardan sadece 57Fe'nin nükleer spini vardır (-1⁄2). 54Fe nüklidi teorik olarak çift elektron yakalayarak 54Cr'ye dönüşebilir, ancak bu süreç hiç gözlemlenmemiştir ve sadece 3,1×1022 yıllık bir yarı ömür alt sınırı belirlenmiştir. ⓘ
60Fe uzun yarı ömürlü (2,6 milyon yıl) soyu tükenmiş bir radyonükliddir. Dünya'da bulunmaz, ancak nihai bozunma ürünü torunu olan kararlı nüklid 60Ni'dir. Demirin izotopik bileşimi üzerine geçmişte yapılan çalışmaların çoğu, meteorit ve cevher oluşumu çalışmaları yoluyla 60Fe'nin nükleosentezine odaklanmıştır. Son on yılda, kütle spektrometresindeki gelişmeler, demirin kararlı izotoplarının oranlarında doğal olarak meydana gelen küçük değişikliklerin tespit edilmesine ve ölçülmesine olanak sağlamıştır. Bu çalışmaların çoğu Dünya ve gezegen bilimi toplulukları tarafından yürütülmektedir, ancak biyolojik ve endüstriyel sistemlere yönelik uygulamalar da ortaya çıkmaktadır. ⓘ
Semarkona ve Chervony Kut meteoritlerinin evrelerinde, 60Fe'nin torunu olan 60Ni konsantrasyonu ile kararlı demir izotoplarının bolluğu arasındaki korelasyon, Güneş Sistemi'nin oluşumu sırasında 60Fe'nin varlığına dair kanıt sağlamıştır. Muhtemelen 60Fe'nin bozunmasıyla açığa çıkan enerji, 26Al tarafından açığa çıkan enerjiyle birlikte, 4,6 milyar yıl önce oluşumlarından sonra asteroitlerin yeniden erimesine ve farklılaşmasına katkıda bulunmuştur. Dünya dışı materyalde bulunan 60Ni bolluğu, Güneş Sistemi'nin kökeni ve erken tarihi hakkında daha fazla bilgi sağlayabilir. ⓘ
En bol bulunan demir izotopu 56Fe, nükleosentezin en yaygın son noktasını temsil ettiği için nükleer bilimcilerin özellikle ilgisini çekmektedir. 56Ni (14 alfa parçacığı) süpernovalardaki nükleer reaksiyonlarda alfa sürecinde daha hafif çekirdeklerden kolayca üretildiğinden (bkz. silikon yanma süreci), aşırı büyük yıldızların içindeki füzyon zincirlerinin son noktasıdır, çünkü 60Zn ile sonuçlanan başka bir alfa parçacığının eklenmesi çok daha fazla enerji gerektirir. Yarı ömrü yaklaşık 6 gün olan bu 56Ni, bu yıldızlarda bol miktarda üretilir, ancak kısa süre sonra süpernova kalıntısı gaz bulutundaki süpernova bozunma ürünleri içinde iki ardışık pozitron emisyonuyla bozunarak önce radyoaktif 56Co'ya, ardından da kararlı 56Fe'ye dönüşür. Bu nedenle demir, kırmızı devlerin çekirdeğinde en bol bulunan elementtir ve demir meteoritlerinde ve Dünya gibi gezegenlerin yoğun metal çekirdeklerinde en bol bulunan metaldir. Ayrıca, yaklaşık olarak aynı atom ağırlığına sahip diğer kararlı metallere göre evrende çok yaygındır. Demir evrende en bol bulunan altıncı elementtir ve en yaygın refrakter elementtir. ⓘ
56Fe'den marjinal olarak daha yüksek bir bağlanma enerjisine sahip olan 62Ni sentezlenerek daha küçük bir enerji kazancı elde edilebilse de, yıldızlardaki koşullar bu işlem için uygun değildir. Süpernovalardaki element üretimi ve Dünya'daki dağılımı, nikel yerine demiri büyük ölçüde tercih eder ve her durumda 56Fe, daha hafif protonların daha yüksek oranı nedeniyle 62Ni'den nükleon başına daha düşük bir kütleye sahiptir. Bu nedenle, demirden daha ağır elementlerin oluşumu için 56Fe çekirdeklerinin hızlı nötron yakalamasını içeren bir süpernova gerekir. ⓘ
Evrenin uzak geleceğinde, proton bozunmasının gerçekleşmediği varsayılırsa, kuantum tünelleme yoluyla meydana gelen soğuk füzyon, sıradan maddedeki hafif çekirdeklerin 56Fe çekirdeklerine kaynaşmasına neden olacaktır. Fisyon ve alfa parçacığı emisyonu daha sonra ağır çekirdeklerin demire dönüşmesini sağlayarak tüm yıldız kütleli nesneleri saf demirden oluşan soğuk kürelere dönüştürecektir. ⓘ
Kökeni ve doğada oluşumu
Kozmogenez
Demirin Dünya gibi kayalık gezegenlerde bol miktarda bulunması, demiri uzaya saçan Ia tipi süpernovaların kaçak füzyonu ve patlaması sırasında bol miktarda üretilmesinden kaynaklanmaktadır. ⓘ
Metalik demir

Metalik veya doğal demir, oksitlenme eğiliminde olduğu için Dünya yüzeyinde nadiren bulunur. Bununla birlikte, Dünya'nın kütlesinin %35'ini oluşturan iç ve dış çekirdeğinin büyük ölçüde, muhtemelen nikel içeren bir demir alaşımından oluştuğuna inanılmaktadır. Sıvı dış çekirdekteki elektrik akımlarının Dünya'nın manyetik alanının kaynağı olduğuna inanılmaktadır. Diğer karasal gezegenlerin (Merkür, Venüs ve Mars) yanı sıra Ay'ın da çoğunlukla demirden oluşan metalik bir çekirdeğe sahip olduğuna inanılmaktadır. M tipi asteroitlerin de kısmen ya da çoğunlukla metalik demir alaşımından oluştuğuna inanılmaktadır. ⓘ
Nadir demir meteoritleri, Dünya yüzeyindeki doğal metalik demirin ana formudur. Soğuk işlenmiş meteoritik demirden yapılmış eşyalar, demir eritme işleminin henüz gelişmediği zamanlardan kalma çeşitli arkeolojik alanlarda bulunmuştur; ve Grönland'daki Inuitlerin Cape York meteoritinden elde edilen demiri alet ve av silahları için kullandıkları bildirilmiştir. Yaklaşık 20 meteordan 1'i benzersiz demir-nikel mineralleri olan taenit (%35-80 demir) ve kamasitten (%90-95 demir) oluşur. Doğal demir, demirin kristalleşmesi için oksijen fugasitesini yeterince düşüren karbon bakımından zengin tortul kayaçlarla temas eden magmalardan oluşan bazaltlarda da nadiren bulunur. Bu durum Tellürik demir olarak bilinir ve Batı Grönland'daki Disko Adası, Rusya'daki Yakutistan ve Almanya'daki Bühl gibi birkaç yerde tanımlanmıştır. ⓘ
Manto mineralleri
Periklaz (MgO) ve vüstitin (FeO) katı bir çözeltisi olan ferroperiklaz (Mg,Fe)O, Dünya'nın alt mantosunun hacminin yaklaşık %20'sini oluşturur, bu da onu silikat perovskit (Mg,Fe)SiO3'ten sonra bu bölgede en bol bulunan ikinci mineral fazı yapar; aynı zamanda alt mantodaki demir için ana konaktır. Mantonun geçiş bölgesinin dibinde, γ-(Mg,Fe)2[SiO4] ↔ (Mg,Fe)[SiO3] + (Mg,Fe)O reaksiyonu γ-olivini silikat perovskit ve ferroperiklaz karışımına dönüştürür ve bunun tersi de geçerlidir. Literatürde, alt mantonun bu mineral fazı genellikle magnezyovüstit olarak da adlandırılır. Silikat perovskit alt mantonun %93'üne kadarını oluşturabilir ve magnezyum demir formu, (Mg,Fe)SiO3, Dünya'da en bol bulunan mineral olarak kabul edilir ve hacminin %38'ini oluşturur. ⓘ
Yerkabuğu

Demir Dünya'da en bol bulunan element olmakla birlikte, bu demirin çoğu iç ve dış çekirdeklerde yoğunlaşmıştır. Dünya'nın kabuğunda bulunan demir oranı, kabuğun toplam kütlesinin yalnızca %5'i kadardır ve bu nedenle bu katmanda en bol bulunan dördüncü elementtir (oksijen, silikon ve alüminyumdan sonra). ⓘ
Kabuktaki demirin çoğu, birçok demir mineralini oluşturmak üzere çeşitli diğer elementlerle birleşmiştir. Önemli bir sınıf, başlıca demir cevherleri olan hematit (Fe2O3), manyetit (Fe3O4) ve siderit (FeCO3) gibi demir oksit mineralleridir. Birçok magmatik kayaç ayrıca sülfür mineralleri pirotit ve pentlandit içerir. Ayrışma sırasında demir, sülfit yataklarından sülfat olarak ve silikat yataklarından bikarbonat olarak sızma eğilimindedir. Bunların her ikisi de sulu çözeltide oksitlenir ve hafif yüksek pH'da bile demir (III) oksit olarak çökelir. ⓘ

Büyük demir birikintileri, demir bakımından fakir şeyl ve çört bantları ile dönüşümlü olarak tekrarlanan ince demir oksit katmanlarından oluşan bir kaya türü olan bantlı demir oluşumlarıdır. Bantlı demir oluşumları 3.700 milyon yıl öncesi ile 1.800 milyon yıl öncesi arasındaki dönemde oluşmuştur. ⓘ
Aşı boyası gibi ince öğütülmüş demir(III) oksitleri veya oksit-hidroksitleri içeren malzemeler, tarih öncesi çağlardan beri sarı, kırmızı ve kahverengi pigmentler olarak kullanılmıştır. Oregon'daki Painted Hills ve Buntsandstein ("renkli kumtaşı", İngiliz Bunter) gibi tüm jeolojik oluşumlar da dahil olmak üzere çeşitli kaya ve killerin rengine de katkıda bulunurlar. Eisensandstein (jurasik bir 'demir kumtaşı', örneğin Almanya'daki Donzdorf'tan) ve İngiltere'deki Bath taşı aracılığıyla, demir bileşikleri birçok tarihi bina ve heykelin sarımsı renginden sorumludur. Mars yüzeyinin meşhur kırmızı rengi, demir oksit bakımından zengin bir regolitten kaynaklanmaktadır. ⓘ
Demir sülfür minerali piritte (FeS2) önemli miktarda demir bulunur, ancak demiri ondan çıkarmak zordur ve bu nedenle kullanılmaz. Aslında demir o kadar yaygındır ki üretim genellikle sadece çok yüksek miktarlarda demir içeren cevherlere odaklanır. ⓘ
Uluslararası Kaynak Paneli'nin Toplumdaki Metal Stokları raporuna göre, toplumda kullanılan küresel demir stoku kişi başına 2.200 kg'dır. Daha gelişmiş ülkeler bu açıdan daha az gelişmiş ülkelerden farklıdır (kişi başına 7.000-14.000 vs 2.000 kg). ⓘ
Okyanuslar
Okyanus bilimi, antik denizlerdeki demirin hem deniz biyotası hem de iklim üzerindeki rolünü ortaya koymuştur. ⓘ
Kimya ve bileşikler
| Oksidasyon devlet |
Temsili bileşik ⓘ |
|---|---|
| -2 (d10) | Disodyum tetrakarbonilferrat (Collman reaktifi) |
| -1 (d9) | Fe 2(CO)2- 8 |
| 0 (d8) | Demir pentakarbonil |
| 1 (d7) | Siklopentadieniliron dikarbonil dimer ("Fp2") |
| 2 (d6) | Demir sülfat, ferrosen |
| 3 (d5) | Ferrik klorür, ferrosenyum tetrafloroborat |
| 4 (d4) | Fe(diars) 2Cl2+ 2, Ferryl tetrafloroborat |
| 5 (d3) | FeO3- 4 |
| 6 (d2) | Potasyum ferrat |
| 7 (d1) | [FeO4]- (matris izolasyonu, 4K) |
Demir, geçiş metallerinin karakteristik kimyasal özelliklerini, yani bir basamakla farklılaşan değişken oksidasyon durumları ve çok geniş bir koordinasyon ve organometalik kimya oluşturma yeteneğini gösterir: gerçekten de, 1950'lerde ikinci alanda devrim yaratan bir demir bileşiği olan ferrosenin keşfiydi. Demir, bolluğu ve insanlığın teknolojik ilerlemesinde oynadığı muazzam rol nedeniyle bazen tüm geçiş metalleri bloğu için bir prototip olarak kabul edilir. Demirin 26 elektronu, 3d ve 4s elektronlarının enerji bakımından nispeten yakın olduğu [Ar]3d64s2 konfigürasyonunda düzenlenmiştir ve bu nedenle değişken sayıda elektron kaybedebilir ve daha fazla iyonlaşmanın kârsız hale geldiği net bir nokta yoktur. ⓘ
Demir esas olarak +2 (demir(II), "demirli") ve +3 (demir(III), "ferrik") oksidasyon durumlarında bileşikler oluşturur. Demir ayrıca daha yüksek oksidasyon durumlarında da oluşur, örneğin +6 oksidasyon durumunda demir içeren mor potasyum ferrat (K2FeO4). Demir (VIII) oksit (FeO4) olduğu iddia edilmiş olsa da, rapor yeniden üretilememiştir ve elementin tüm elektronlarının önceki inert gaz konfigürasyonunun ötesine çıkarılmasından kaynaklanan böyle bir türün (en azından +8 oksidasyon durumundaki demir ile) hesaplamalı olarak olası olmadığı bulunmuştur. Bununla birlikte, +7 oksidasyon durumunda demir içeren bir anyonik [FeO4]- formu, bir demir(V)-perokso izomeri ile birlikte, O2/Ar karışımı ile lazerle şişirilmiş Fe atomlarının kokondensasyonundan sonra 4 K'de kızılötesi spektroskopisi ile tespit edilmiştir. Demir(IV) birçok biyokimyasal oksidasyon reaksiyonunda yaygın bir ara maddedir. Çok sayıda organo-demir bileşiği +1, 0, -1 ve hatta -2 resmi oksidasyon durumları içerir. Oksidasyon durumları ve diğer bağlanma özellikleri genellikle Mössbauer spektroskopisi tekniği kullanılarak değerlendirilir. Birçok karışık değerlikli bileşik, manyetit ve Prusya mavisi (Fe4(Fe[CN]6)3) gibi hem demir(II) hem de demir(III) merkezleri içerir. Sonuncusu, planlarda geleneksel "mavi" olarak kullanılır. ⓘ
Demir, geçiş metalleri arasında kendi grup oksidasyon durumu olan +8'e ulaşamayan ilk metaldir, ancak daha ağır türleri olan rutenyum ve osmiyum ulaşabilir ve rutenyum osmiyumdan daha fazla zorluk çeker. Rutenyum, düşük oksidasyon durumlarında demirinkine benzer sulu katyonik bir kimya sergiler, ancak osmiyum bunu yapmaz ve anyonik kompleksler oluşturduğu yüksek oksidasyon durumlarını tercih eder. 3 boyutlu geçiş serisinin ikinci yarısında, gruplardaki dikey benzerlikler, demirin periyodik tablodaki komşuları kobalt ve nikel ile olan yatay benzerlikleriyle rekabet eder; bunlar da oda sıcaklığında ferromanyetiktir ve benzer kimyayı paylaşırlar. Bu nedenle demir, kobalt ve nikel bazen demir üçlüsü olarak birlikte gruplandırılır. ⓘ
Diğer birçok metalin aksine demir, cıva ile amalgam oluşturmaz. Sonuç olarak cıva, demirden yapılmış standartlaştırılmış 76 poundluk şişelerde (34 kg) işlem görür. ⓘ
Demir, kendi grubundaki en reaktif elementtir; ince bölündüğünde piroforiktir ve seyreltik asitlerde kolayca çözünerek Fe2+ verir. Bununla birlikte, geçirimsiz bir oksit tabakası oluşturması nedeniyle konsantre nitrik asit ve diğer oksitleyici asitlerle reaksiyona girmez, ancak yine de hidroklorik asitle reaksiyona girebilir. Elektrolitik demir olarak adlandırılan yüksek saflıktaki demirin, oksit tabakası nedeniyle paslanmaya karşı dirençli olduğu düşünülmektedir. ⓘ
İkili bileşikler
Oksitler ve hidroksitler
Demir çeşitli oksit ve hidroksit bileşikleri oluşturur; en yaygın olanları demir(II,III) oksit (Fe3O4) ve demir(III) oksittir (Fe2O3). Demir(II) oksit de mevcuttur, ancak oda sıcaklığında kararsızdır. İsimlerine rağmen, aslında hepsi bileşimleri değişebilen stokiyometrik olmayan bileşiklerdir. Bu oksitler demir üretimi için ana cevherlerdir (bkz. bloomery ve yüksek fırın). Ayrıca ferritlerin, bilgisayarlarda faydalı manyetik depolama ortamlarının ve pigmentlerin üretiminde de kullanılırlar. En iyi bilinen sülfit, altın parlaklığı nedeniyle aptal altını olarak da bilinen demir pirittir (FeS2). Bu bir demir(IV) bileşiği değildir, aslında Fe2+ ve S2- içeren bir demir(II) polisülfittir.
2 iyonlarının çarpıtılmış sodyum klorür yapısında bulunması. ⓘ

Halojenürler

İkili demir ve ferrik halojenürler iyi bilinmektedir. Demir halojenürler tipik olarak demir metalinin karşılık gelen hidrohalik asit ile muamele edilerek karşılık gelen hidratlı tuzların elde edilmesiyle ortaya çıkar.
- Fe + 2 HX → FeX2 + H2 (X = F, Cl, Br, I)
Demir flor, klor ve brom ile reaksiyona girerek en yaygın olanı ferrik klorür olmak üzere ilgili ferrik halojenürleri verir.
- 2 Fe + 3 X2 → 2 FeX3 (X = F, Cl, Br)
Ferrik iyodür bir istisnadır, Fe3+'ün oksitleyici gücü ve I-'nin yüksek indirgeme gücü nedeniyle termodinamik olarak kararsızdır:
- 2 I- + 2 Fe3+ → I2 + 2 Fe2+ (E0 = +0,23 V) ⓘ
Siyah bir katı olan ferrik iyodür normal koşullarda kararlı değildir, ancak demir pentakarbonilin iyot ve karbon monoksit ile hekzan ve ışık varlığında -20 °C sıcaklıkta, oksijen ve su hariç tutularak reaksiyonu yoluyla hazırlanabilir. Ferrik iyodürün bazı yumuşak bazlarla komplekslerinin kararlı bileşikler olduğu bilinmektedir. ⓘ
Çözelti kimyası

Bazı yaygın demir iyonları için asidik sulu çözeltideki standart indirgeme potansiyelleri aşağıda verilmiştir:
| Fe2+ + 2 e- | ⇌ Fe | E0 = -0,447 V ⓘ |
| Fe3+ + 3 e- | ⇌ Fe | E0 = -0,037 V |
| FeO2- 4 + 8 H+ + 3 e- |
⇌ Fe3+ + 4 H2O | E0 = +2,20 V |
Kırmızı-mor tetrahedral ferrat(VI) anyonu o kadar güçlü bir oksitleyici maddedir ki oda sıcaklığında nitrojen ve amonyağı ve hatta asidik veya nötr çözeltilerde suyun kendisini bile oksitleyebilir:
- 4 FeO2-
4 + 10 H
2O → 4 Fe3+
+ 20 OH-
+ 3 O2 ⓘ
Fe3+ iyonu büyük bir basit katyonik kimyaya sahiptir, ancak soluk-mor hekzako iyonu [Fe(H2O)6]3+ pH 0'ın üzerine çıktığında aşağıdaki gibi çok kolay hidrolize olur:
| [Fe(H2O)6]3+ | ⇌ [Fe(H2O)5(OH)]2+ + H+ | K = 10-3,05 mol dm-3 ⓘ |
| [Fe(H2O)5(OH)]2+ | ⇌ [Fe(H2O)4(OH)2]+ + H+ | K = 10-3,26 mol dm-3 |
| 2[Fe(H2O)6]3+ | ⇌ [Fe(H2O)4(OH)]4+2 + 2H+ + 2H2O | K = 10-2,91 mol dm-3 |

pH 0'ın üzerine çıktıkça yukarıdaki sarı hidrolize türler oluşur ve 2-3'ün üzerine çıktıkça kırmızımsı kahverengi sulu demir (III) oksit çözeltiden çöker. Fe3+ d5 konfigürasyonuna sahip olmasına rağmen, absorpsiyon spektrumu zayıf, spin yasaklı d-d bantlarına sahip Mn2+ gibi değildir, çünkü Fe3+ daha yüksek pozitif yüke sahiptir ve daha polarizedir, ligand-metal yük transferi absorpsiyonlarının enerjisini düşürür. Bu nedenle, hekzakuo iyonu haricinde yukarıdaki tüm kompleksler oldukça güçlü renklidir ve bu bile yakın ultraviyole bölgesinde yük transferinin hakim olduğu bir spektruma sahiptir. Öte yandan, soluk yeşil demir(II) heksaquo iyonu [Fe(H2O)6]2+ kayda değer bir hidrolize uğramaz. Karbonat anyonları eklendiğinde karbondioksit açığa çıkmaz, bunun yerine beyaz demir(II) karbonat çökelir. Karbondioksit fazlalığında bu, yeraltı sularında yaygın olarak bulunan hafif çözünür bikarbonatı oluşturur, ancak havada hızla oksitlenerek demir (III) oksit oluşturur ve bu da oldukça fazla sayıda akarsuda bulunan kahverengi tortuları açıklar. ⓘ
Koordinasyon bileşikleri
Elektronik yapısı nedeniyle demir, çok geniş bir koordinasyon ve organometalik kimyaya sahiptir. ⓘ

Demirin birçok koordinasyon bileşiği bilinmektedir. Tipik bir altı koordinatlı anyon, karışık tuz tetrakis (metilamonyum) hekzakloroferrat (III) klorürde bulunan hekzakloroferrat (III), [FeCl6]3-'tür. Birden fazla bidentat ligand içeren komplekslerin geometrik izomerleri vardır. Örneğin, trans-klorohidridobis(bis-1,2-(difenilfosfino)etan)demir(II) kompleksi, Fe(dppe)2 parçasına sahip bileşikler için bir başlangıç malzemesi olarak kullanılır. Üç oksalat ligandına sahip ferrioksalat iyonu (sağda gösterilmiştir), IUPAC kurallarına uygun olarak sol elli vida ekseni için Λ (lambda) ve sağ elli vida ekseni için Δ (delta) olarak etiketlenmiş iki süperpoze olmayan geometrisi ile sarmal kiralite gösterir. Potasyum ferrioksalat kimyasal aktinometride kullanılır ve sodyum tuzu ile birlikte eski tip fotoğrafik işlemlerde uygulanan fotoredüksiyona uğrar. Demir(II) oksalatın dihidratı, aşağıda gösterildiği gibi, her bir oktahedronun kapaklarını oluşturan kristalleşme suyu ile demir merkezleri arasında köprü oluşturan eş düzlemli oksalat iyonları ile polimerik bir yapıya sahiptir. ⓘ


Demir(III) kompleksleri, demir(III)'ün N-donör ligandlar yerine O-donör tercih etmesi haricinde krom(III) komplekslerine oldukça benzerdir. İkincisi, demir(II) komplekslerinden daha kararsız olma eğilimindedir ve genellikle suda ayrışır. Birçok Fe-O kompleksi yoğun renkler gösterir ve fenoller veya enoller için test olarak kullanılır. Örneğin, fenollerin varlığını belirlemek için kullanılan ferrik klorür testinde, demir(III) klorür bir fenol ile reaksiyona girerek koyu mor bir kompleks oluşturur:
- 3 ArOH + FeCl3 → Fe(OAr)3 + 3 HCl (Ar = aril) ⓘ
Halojenür ve psödohalojenür kompleksleri arasında, demir(III)'ün floro kompleksleri en kararlı olanlarıdır; renksiz [FeF5(H2O)]2- sulu çözeltide en kararlı olanıdır. Kloro kompleksleri daha az kararlıdır ve [FeCl4]-'de olduğu gibi tetrahedral koordinasyonu tercih eder; [FeBr4]- ve [FeI4]- kolayca demir(II)'ye indirgenir. Tiyosiyanat, kan kırmızısı [Fe(SCN)(H2O)5]2+ oluşturduğundan demir(III) varlığı için yaygın bir testtir. Manganez(II) gibi, çoğu demir(III) kompleksi yüksek spinlidir, istisnalar siyanür gibi spektrokimyasal seride yüksek ligandlara sahip olanlardır. Düşük spinli demir(III) kompleksine bir örnek [Fe(CN)6]3-'tür. Siyanür ligandları [Fe(CN)6]3-'te kolayca ayrılabilir ve bu nedenle bu kompleks, Prusya mavisinde bulunan ve seyreltik asitler eklenmedikçe hidrojen siyanür salmayan demir (II) kompleksi [Fe(CN)6]4-'ün aksine zehirlidir. Demir, 0'dan (diyamanyetik) 5⁄2'ye (5 eşleşmemiş elektron) kadar bir d-blok elementi için olası her spin kuantum sayısı değeri dahil olmak üzere çok çeşitli elektronik spin durumları gösterir. Bu değer her zaman eşleşmemiş elektron sayısının yarısıdır. Sıfır ila iki eşleşmemiş elektrona sahip kompleksler düşük spinli, dört veya beş elektrona sahip olanlar ise yüksek spinli olarak kabul edilir. ⓘ
Demir(II) kompleksleri demir(III) komplekslerinden daha az kararlıdır, ancak O-donör ligandları için tercih daha az belirgindir, böylece örneğin [Fe(NH3)6]2+ bilinirken [Fe(NH3)6]3+ bilinmez. Demir(III)'e oksitlenme eğilimleri vardır, ancak bu düşük pH ve kullanılan spesifik ligandlar ile hafifletilebilir. ⓘ
Organometalik bileşikler
Organodemir kimyası, karbon atomlarının metal atomuna kovalent olarak bağlandığı organometalik demir bileşiklerinin incelenmesidir. Siyanür kompleksleri, karbonil kompleksleri, sandviç ve yarım sandviç bileşikleri dahil olmak üzere çok sayıda ve çeşitlidirler. ⓘ
Prusya mavisi veya "ferrik ferrosiyanür", Fe4[Fe(CN)6]3, pigment olarak ve diğer birçok uygulamada yaygın olarak kullanılan eski ve iyi bilinen bir demir-siyanür kompleksidir. Oluşumu, Prusya mavisi oluşturmak için potasyum ferrisiyanür ve potasyum ferrosiyanür ile reaksiyona girdiklerinde (sırasıyla) Fe2+ ve Fe3+'ün sulu çözeltilerini ayırt etmek için basit bir ıslak kimya testi olarak kullanılabilir. ⓘ
Organo demir bileşiğinin bir diğer eski örneği, nötr bir demir atomunun beş karbon monoksit molekülünün karbon atomlarına bağlandığı demir pentakarbonil, Fe(CO)5'tir. Bu bileşik, metalik demirin oldukça reaktif bir formu olan karbonil demir tozu yapmak için kullanılabilir. Demir pentakarbonilin termolizi, çekirdeğinde üç demir atomu kümesi bulunan bir kompleks olan triiron dodekakarbonil, Fe3(CO)12 verir. Collman'ın reaktifi, disodyum tetrakarbonilferrat, organik kimya için yararlı bir reaktiftir; -2 oksidasyon durumunda demir içerir. Siklopentadienildemir dikarbonil dimer, nadir +1 oksidasyon durumunda demir içerir. ⓘ
Bu alanda bir dönüm noktası, 1951 yılında Paulson ve Kealy tarafından ve bağımsız olarak Miller ve diğerleri tarafından şaşırtıcı moleküler yapısı sadece bir yıl sonra Woodward ve Wilkinson ve Fischer tarafından belirlenen son derece kararlı sandviç bileşiği ferrosen Fe(C5H5)2'nin keşfiydi. Ferrosen hala bu sınıftaki en önemli araç ve modellerden biridir. ⓘ
Demir merkezli organometalik türler katalizör olarak kullanılır. Örneğin Knölker kompleksi, ketonlar için bir transfer hidrojenasyon katalizörüdür. ⓘ
Endüstriyel kullanımlar
Endüstride en büyük ölçekte üretilen demir bileşikleri demir(II) sülfat (FeSO4-7H2O) ve demir(III) klorürdür (FeCl3). İlki en kolay bulunabilen demir(II) kaynaklarından biridir, ancak hava oksidasyonuna karşı Mohr tuzundan ((NH4)2Fe(SO4)2-6H2O) daha az kararlıdır. Demir(II) bileşikleri havada demir(III) bileşiklerine oksitlenme eğilimindedir. ⓘ
Tarih
Demir metalürjisinin gelişimi
Demir, antik dünya tarafından şüphesiz bilinen elementlerden biridir. Binlerce yıldır işlenmiş ya da işlenmeye devam etmektedir. Ancak, demirin kolaylıkla aşınması nedeniyle çok eski demir objeler altın ya da gümüşten yapılmış objelere kıyasla çok daha nadirdir. Teknoloji yavaş gelişmiştir ve eritmenin keşfinden sonra bile alet ve silahlar için tercih edilen metal olarak demirin bronzun yerini alması yüzyıllar almıştır. ⓘ
Meteoritik demir
G.A. Wainwright tarafından Mısır'ın Gerzeh kentinde M.Ö. 3500 yıllarında veya daha önce meteorik demirden yapılmış boncuklar bulunmuştur. Boncuklar %7,5 nikel içermektedir ki bu da meteorik kökenli olduğunun bir göstergesidir zira yerkabuğunda bulunan demirde genellikle çok az nikel safsızlığı bulunur. ⓘ
Meteorik demir, göklerdeki kökeni nedeniyle büyük saygı görür ve genellikle silah ve aletlerin dövülmesinde kullanılırdı. Örneğin, Tutankamon'un mezarında meteorik demirden yapılmış bir hançer bulunmuştur ve bölgede keşfedilen ve eski bir meteor yağmuru tarafından biriktirilen bir meteoritle benzer oranlarda demir, kobalt ve nikel içermektedir. Mısırlılar tarafından demirden yapılmış olması muhtemel eşyalar MÖ 3000 ila 2500 yılları arasına tarihlenmektedir. ⓘ
Meteoritik demir nispeten yumuşak ve sünektir ve kolayca soğuk dövülebilir ancak nikel içeriği nedeniyle ısıtıldığında kırılgan hale gelebilir. ⓘ
Dövme demir

İlk demir üretimi Orta Tunç Çağı'nda başlamış, ancak demirin bronzun yerini alması birkaç yüzyıl almıştır. Asmar, Mezopotamya ve Kuzey Suriye'deki Tall Chagar Bazaar'dan eritilmiş demir örnekleri M.Ö. 3000 ile 2700 yılları arasında yapılmıştır. Hititler MÖ 1600 civarında kuzey-orta Anadolu'da bir imparatorluk kurmuşlardır. Demirin cevherlerinden üretimini ilk anlayanlar ve toplumlarında demire büyük önem verenler onlar gibi görünmektedir. Hititler demiri MÖ 1500 ile 1200 yılları arasında eritmeye başlamış ve imparatorlukları MÖ 1180'de yıkıldıktan sonra bu uygulama Yakın Doğu'nun geri kalanına yayılmıştır. Bunu izleyen dönem Demir Çağı olarak adlandırılır. ⓘ
Hindistan'da MÖ 1800 ila 1200 yılları arasında, Levant'ta ise MÖ 1500'lerden itibaren (Anadolu ya da Kafkasya'da eritildiğini düşündüren) eritilmiş demir eserleri bulunmuştur. Hint Vedalarında demirle ilgili olduğu iddia edilen referanslar (Güney Asya'daki metalürji tarihiyle karşılaştırın), Hindistan'da demirin çok erken bir tarihte kullanıldığına dair iddialar için kullanılmıştır. Rigveda'daki ayas (metal) terimi bakır anlamına gelirken, śyāma ayas, yani "siyah bakır" olarak adlandırılan demirden ilk kez Rigveda sonrası Atharvaveda'da bahsedilir. ⓘ
Bazı arkeolojik kanıtlar demirin Zimbabve ve Güneydoğu Afrika'da MÖ sekizinci yüzyıl gibi erken bir tarihte eritildiğini göstermektedir. Demir işçiliği Yunanistan'a MÖ 11. yüzyılın sonlarında girmiş ve buradan Avrupa'ya hızla yayılmıştır. ⓘ

Demir işlemeciliğinin Orta ve Batı Avrupa'da yayılması Kelt yayılmasıyla ilişkilendirilmektedir. Yaşlı Plinius'a göre Roma döneminde demir kullanımı yaygındı. Günümüzde Çin olarak kabul edilen topraklarda demir yaklaşık olarak MÖ 700-500 yıllarında ortaya çıkmıştır. Demir eritme işlemi Çin'e Orta Asya üzerinden girmiş olabilir. Çin'de yüksek fırın kullanımına dair en eski kanıt MS 1. yüzyıla aittir ve kupol fırınları Savaşan Devletler dönemi (MÖ 403-221) kadar erken bir tarihte kullanılmıştır. Yüksek fırın ve kupol fırını kullanımı Song ve Tang Hanedanlıkları döneminde de yaygınlığını korumuştur. ⓘ
İngiltere'deki Sanayi Devrimi sırasında Henry Cort, yenilikçi üretim sistemleri kullanarak demiri pik demirden dövme demire (veya çubuk demire) dönüştürmeye başlamıştır. 1783 yılında demir cevherini rafine etmek için puddling prosesinin patentini aldı. Bu yöntem daha sonra Joseph Hall da dahil olmak üzere başkaları tarafından geliştirildi. ⓘ
Dökme demir
Dökme demir ilk olarak M.Ö. 5. yüzyılda Çin'de üretilmiş, ancak ortaçağa kadar Avrupa'da pek görülmemiştir. En eski dökme demir eserler arkeologlar tarafından günümüzde Çin'in Jiangsu eyaletinde bulunan modern Luhe ilçesinde keşfedilmiştir. Dökme demir antik Çin'de savaş, tarım ve mimari için kullanılmıştır. Ortaçağ döneminde, Avrupa'da dökme demirden (bu bağlamda pik demir olarak bilinir) ince demir ocakları kullanılarak dövme demir üretmenin yolları bulunmuştur. Tüm bu işlemler için yakıt olarak odun kömürü gerekliydi. ⓘ

Ortaçağ yüksek fırınları yaklaşık 10 feet (3.0 m) boyunda ve yanmaz tuğladan yapılmıştı; basınçlı hava genellikle elle çalıştırılan körüklerle sağlanırdı. Modern yüksek fırınlar, her gün binlerce ton demir üretmelerine olanak tanıyan on dört metre çapındaki ocaklarla çok daha büyük hale gelmiştir, ancak esasen ortaçağda olduğu gibi çalışırlar. ⓘ
1709 yılında I. Abraham Darby, dökme demir üretmek için kok kömürü ile çalışan bir yüksek fırın kurarak kömürün yerini almış, ancak yüksek fırınları kullanmaya devam etmiştir. Böylece ucuz demirin elde edilmesi Sanayi Devrimi'ne yol açan faktörlerden biri oldu. XVIII. yüzyılın sonlarına doğru dökme demir, daha ucuz olduğu için belirli amaçlar için dövme demirin yerini almaya başladı. Demirdeki karbon içeriği, 18. yüzyıla kadar dövme demir, dökme demir ve çeliğin özelliklerindeki farklılıkların nedeni olarak gösterilmemiştir. ⓘ
Demir daha ucuz ve bol hale geldiğinden, 1778'de yenilikçi ilk demir köprünün inşa edilmesinin ardından önemli bir yapısal malzeme haline geldi. Bu köprü bugün hala demirin Sanayi Devrimi'nde oynadığı rolün bir anıtı olarak ayakta durmaktadır. Bunu takiben demir; raylar, tekneler, gemiler, su kemerleri ve binaların yanı sıra buhar makinelerindeki demir silindirlerde de kullanıldı. Demiryolları modernitenin ve ilerleme fikirlerinin oluşumunda merkezi bir rol oynamıştır ve çeşitli dillerde (örneğin Fransızca, İspanyolca, İtalyanca ve Almanca) demiryollarından demir yolu olarak bahsedilmektedir. ⓘ
Çelik
Çelik (pik demirden daha az ancak dövme demirden daha fazla karbon içeriğine sahip) ilk olarak antik çağda bir bloomery kullanılarak üretilmiştir. Batı İran'daki Luristan'daki demirciler MÖ 1000'lerde iyi çelik üretiyorlardı. Daha sonra geliştirilmiş versiyonlar, Hindistan'da Wootz çeliği ve Şam çeliği sırasıyla MÖ 300 ve MS 500 civarında geliştirildi. Bu yöntemler uzmanlık gerektiren yöntemlerdi ve bu nedenle çelik 1850'lere kadar önemli bir meta haline gelmedi. ⓘ
Sementasyon işleminde demir çubukları karbonlaştırarak üretmek için yeni yöntemler 17. yüzyılda geliştirildi. Sanayi Devrimi'nde, kömür kullanmadan çubuk demir üretmek için yeni yöntemler geliştirilmiş ve bunlar daha sonra çelik üretmek için uygulanmıştır. 1850'lerin sonlarında Henry Bessemer, yumuşak çelik üretmek için erimiş pik demirden hava üflemeyi içeren yeni bir çelik üretim süreci icat etti. Bu, çeliği çok daha ekonomik hale getirdi ve böylece dövme demirin artık büyük miktarlarda üretilmemesine yol açtı. ⓘ
Modern kimyanın temelleri
1774 yılında Antoine Lavoisier, kimyayı nitel bir bilimden nicel bir bilime dönüştürmede etkili olan kütlenin korunumunun gösterilmesine yol açan deneylerinde hidrojen üretmek için akkor halindeki bir demir tüpün içindeki metalik demir ile su buharının reaksiyonunu kullanmıştır. ⓘ
Sembolik rol

Demir mitolojide belirli bir rol oynar ve bir metafor olarak ve folklorda çeşitli kullanımlar bulmuştur. Yunan şair Hesiod'un İşler ve Günler adlı eserinde (109-201. satırlar) insanlığın birbirini izleyen çağlarını açıklamak için altın, gümüş, bronz ve demir gibi metallerin adlarıyla anılan farklı insan çağları sıralanır. Demir Çağı Roma ile yakından ilişkiliydi ve Ovid'in Metamorphoses'inde ⓘ
Erdemler çaresizlik içinde yeryüzünü terk eder; ve insanın ahlaksızlığı evrensel ve eksiksiz hale gelir. O zaman sert çelik başarılı oldu.
- Ovid, Metamorphoses, Kitap I, Demir Çağı, satır 160 vd ⓘ
Demirin sembolik rolünün önemine dair bir örnek 1813 Alman Seferi'nde bulunabilir. Frederick William III o dönemde askeri nişan olarak ilk Demir Haç'ı yaptırmıştır. Berlin demir takıları, Prusya kraliyet ailesinin vatandaşları askeri fonlar için altın ve gümüş takılar bağışlamaya çağırdığı 1813 ve 1815 yılları arasında en yüksek üretime ulaşmıştır. Gold gab ich für Eisen (Demir için altın verdim) yazısı daha sonraki savaş çabalarında da kullanıldı. ⓘ
Metalik demir üretimi


Laboratuvar rotaları
İhtiyaç duyulduğunda birkaç sınırlı amaç için, saf demir, saf oksit veya hidroksitin hidrojenle indirgenmesi veya demir pentakarbonil oluşturulması ve saf demir tozu oluşturmak üzere ayrışması için 250 °C'ye kadar ısıtılmasıyla laboratuvarda küçük miktarlarda üretilir. Diğer bir yöntem ise demir klorürün demir katot üzerinde elektrolizidir. ⓘ
Ana endüstriyel yol
| Ülke | Demir cevheri | Pik demir | Doğrudan demir | Çelik ⓘ |
|---|---|---|---|---|
| 1,114.9 | 549.4 | 573.6 | ||
| 393.9 | 4.4 | 5.2 | ||
| 305.0 | 25.1 | 0.011 | 26.5 | |
| 66.9 | 87.5 | |||
| 257.4 | 38.2 | 23.4 | 63.5 | |
| 92.1 | 43.9 | 4.7 | 60.0 | |
| 65.8 | 25.7 | 29.9 | ||
| 0.1 | 27.3 | 48.6 | ||
| 0.4 | 20.1 | 0.38 | 32.7 | |
| Dünya | 1,594.9 | 914.0 | 64.5 | 1,232.4 |
Günümüzde demir veya çeliğin endüstriyel üretimi iki ana aşamadan oluşmaktadır. İlk aşamada, demir cevheri bir yüksek fırında kok kömürü ile indirgenir ve erimiş metal silikat mineralleri gibi kaba safsızlıklardan ayrılır. Bu aşamada nispeten büyük miktarlarda karbon içeren bir alaşım -domuz demiri- elde edilir. İkinci aşamada, pik demirdeki karbon miktarı oksidasyon yoluyla düşürülerek dövme demir, çelik veya dökme demir elde edilir. Bu aşamada alaşımlı çelikler oluşturmak için başka metaller de eklenebilir.

Yüksek fırın işleme
Yüksek fırın, genellikle hematit Fe2O3 veya manyetit Fe3O4 olan demir cevherleri, kok kömürü (uçucu bileşenleri gidermek için ayrı olarak fırınlanmış kömür) ve flaks (kireçtaşı veya dolomit) ile birlikte yüklenir. Karbonu karbon monoksite dönüştürmeye yetecek miktarda, önceden 900 °C'ye ısıtılmış (bazen oksijenle zenginleştirilmiş) hava "püskürtülerek" karışıma üflenir:
- Ayrıştırılamadı (sözdizim hatası): {\displaystyle \ce{ 2 C + O2 -> 2 CO <span title="Kaynak: İngilizce Vikipedi, Bölüm "Blast furnace processing"" class="plainlinks">[https://en.wikipedia.org/wiki/Iron#Blast_furnace_processing <span style="color:#dddddd">ⓘ</span>]</span> }}
Bu reaksiyon sıcaklığı yaklaşık 2000 °C'ye yükseltir. Karbon monoksit demir cevherini metalik demire indirger ⓘ
- Ayrıştırılamadı (sözdizim hatası): {\displaystyle \ce{Fe2O3 + 3 CO -> 2 Fe + 3 CO2 <span title="Kaynak: İngilizce Vikipedi, Bölüm "Blast furnace processing"" class="plainlinks">[https://en.wikipedia.org/wiki/Iron#Blast_furnace_processing <span style="color:#dddddd">ⓘ</span>]</span>}}
Fırının yüksek sıcaklıktaki alt bölgesindeki bir miktar demir doğrudan kok ile reaksiyona girer:
- Ayrıştırılamadı (sözdizim hatası): {\displaystyle \ce{2Fe2O3 + 3C -> 4Fe + 3CO2 <span title="Kaynak: İngilizce Vikipedi, Bölüm "Blast furnace processing"" class="plainlinks">[https://en.wikipedia.org/wiki/Iron#Blast_furnace_processing <span style="color:#dddddd">ⓘ</span>]</span>}}
Flaks, aksi takdirde fırını tıkayacak olan cevherdeki silisli mineralleri giderir: Fırının ısısı karbonatları kalsiyum okside ayrıştırır, bu da kalsiyum silikat CaSiO3 veya diğer ürünlerden oluşan bir cüruf oluşturmak için fazla silika ile reaksiyona girer. Fırın sıcaklığında, metal ve cürufun her ikisi de erimiş haldedir. Altta iki karışmayan sıvı katman olarak toplanırlar (cüruf üstte olacak şekilde) ve daha sonra kolayca ayrılırlar. Cüruf, yol yapımında malzeme olarak veya tarım için mineral bakımından fakir toprakları iyileştirmek için kullanılabilir. ⓘ
Bu nedenle çelik üretimi, dünyadaki CO2 emisyonlarına en büyük endüstriyel katkılardan biri olmaya devam etmektedir. ⓘ

Çelik üretimi

Yüksek fırın prosesi ile üretilen pik demir, kükürt, magnezyum, fosfor ve manganez gibi az miktarda diğer safsızlıklarla birlikte %4-5'e kadar karbon (kütlece) içerir. Bu yüksek karbon seviyesi onu nispeten zayıf ve kırılgan hale getirir. Karbon miktarının %0,002-2,1'e düşürülmesi, saf demirden 1000 kat daha sert olabilen çelik üretir. Daha sonra soğuk işleme, sıcak haddeleme, dövme, işleme vb. yöntemlerle çok çeşitli çelik ürünler üretilebilir. Pik demirden safsızlıkların giderilmesi, ancak %2-4 karbon bırakılması, dökümhaneler tarafından soba, boru, radyatör, lamba direği ve ray gibi eşyalara dökülen dökme demir ile sonuçlanır. ⓘ
Çelik ürünler dövülerek şekillendirildikten sonra genellikle çeşitli ısıl işlemlerden geçirilir. Tavlama, birkaç saat boyunca 700-800 °C'ye kadar ısıtılmalarını ve ardından kademeli olarak soğutulmalarını içerir. Bu işlem çeliği daha yumuşak ve işlenebilir hale getirir. ⓘ
Doğrudan demir indirgeme
Çevresel kaygılar nedeniyle demiri işlemek için alternatif yöntemler geliştirilmiştir. "Doğrudan demir indirgeme" demir cevherini "sünger" demir ya da çelik yapımına uygun "doğrudan" demir olarak adlandırılan demirli bir parçaya indirger. Doğrudan indirgeme işlemini iki ana reaksiyon oluşturur: Doğal gaz kısmen oksitlenir (ısı ve bir katalizör ile):
- Ayrıştırılamadı (sözdizim hatası): {\displaystyle \ce{2 CH4 + O2 -> 2 CO + 4 H2 <span title="Kaynak: İngilizce Vikipedi, Bölüm "Direct iron reduction"" class="plainlinks">[https://en.wikipedia.org/wiki/Iron#Direct_iron_reduction <span style="color:#dddddd">ⓘ</span>]</span>}}
Demir cevheri daha sonra bir fırında bu gazlarla işlenerek katı sünger demir üretilir:
- Ayrıştırılamadı (sözdizim hatası): {\displaystyle \ce{Fe2O3 + CO + 2 H2 -> 2 Fe + CO2 + 2 H2O <span title="Kaynak: İngilizce Vikipedi, Bölüm "Direct iron reduction"" class="plainlinks">[https://en.wikipedia.org/wiki/Iron#Direct_iron_reduction <span style="color:#dddddd">ⓘ</span>]</span>}}
Silika, yukarıda açıklandığı gibi bir kireçtaşı akısı eklenerek giderilir. ⓘ
Termit işlemi
Alüminyum tozu ve demir oksit karışımının tutuşturulması termit reaksiyonu yoluyla metalik demir verir:
- Ayrıştırılamadı (sözdizim hatası): {\displaystyle \ce{Fe2O3 + 2 Al -> 2 Fe + Al2O3 <span title="Kaynak: İngilizce Vikipedi, Bölüm "Thermite process"" class="plainlinks">[https://en.wikipedia.org/wiki/Iron#Thermite_process <span style="color:#dddddd">ⓘ</span>]</span>}}
Alternatif olarak pik demir çelik (yaklaşık %2'ye kadar karbon içeren) veya dövme demir (ticari olarak saf demir) haline getirilebilir. Bunun için ince dövme fırınları, puddling fırınları, Bessemer konvertörleri, açık ocak fırınları, bazik oksijen fırınları ve elektrik ark fırınları dahil olmak üzere çeşitli işlemler kullanılmıştır. Her durumda amaç, diğer safsızlıklarla birlikte karbonun bir kısmını veya tamamını oksitlemektir. Öte yandan, alaşımlı çelikler yapmak için başka metaller de eklenebilir. ⓘ
Uygulamalar
Yapısal malzeme olarak
Demir, tüm metaller arasında en yaygın kullanılanıdır ve dünya çapındaki metal üretiminin %90'ından fazlasını oluşturur. Düşük maliyeti ve yüksek mukavemeti, onu makine ve takım tezgahları, raylar, otomobiller, gemi gövdeleri, beton takviye çubukları ve binaların yük taşıma iskeleti gibi strese dayanmak veya kuvvetleri iletmek için genellikle tercih edilen malzeme haline getirir. Saf demir oldukça yumuşak olduğundan, çelik yapmak için en yaygın olarak alaşım elementleriyle birleştirilir. ⓘ
Mekanik özellikler
| Malzeme | TS (MPa) |
BH (Brinell) ⓘ |
|---|---|---|
| Demir bıyıklar | 11000 | |
| Ausformed (sertleştirilmiş) Çelik |
2930 | 850–1200 |
| Martensitik çelik | 2070 | 600 |
| Beynitik çelik | 1380 | 400 |
| Perlitik çelik | 1200 | 350 |
| Soğuk işlenmiş demir | 690 | 200 |
| Küçük taneli demir | 340 | 100 |
| Karbon içeren demir | 140 | 40 |
| Saf, tek kristalli demir | 10 | 3 |
Demir ve alaşımlarının mekanik özellikleri, yapısal uygulamalarıyla son derece ilgilidir. Bu özellikler Brinell testi, Rockwell testi ve Vickers sertlik testi de dahil olmak üzere çeşitli şekillerde değerlendirilebilir. ⓘ
Saf demirin özellikleri genellikle ölçümleri kalibre etmek veya testleri karşılaştırmak için kullanılır. Bununla birlikte, demirin mekanik özellikleri numunenin saflığından önemli ölçüde etkilenir: saf, tek kristalli demir aslında alüminyumdan daha yumuşaktır ve endüstriyel olarak üretilen en saf demir (%99,99) 20-30 Brinell sertliğe sahiptir. Özellikle elektrolitik demir olarak adlandırılan saf demir (%99,9~%99,999), endüstriyel olarak elektrolitik arıtma ile üretilir. ⓘ
Karbon içeriğindeki bir artış, demirin sertliğinde ve gerilme mukavemetinde önemli bir artışa neden olacaktır. Alaşım düşük çekme mukavemetine sahip olmasına rağmen, %0,6 karbon içeriği ile 65 Rc maksimum sertliğe ulaşılır. Demirin yumuşaklığı nedeniyle, daha ağır türdeşleri olan rutenyum ve osmiyumdan çok daha kolay işlenebilir. ⓘ

Çelik ve alaşım türleri
α-Demir sadece küçük bir karbon konsantrasyonunu çözebilen oldukça yumuşak bir metaldir (910 °C'de kütlece en fazla %0,021). Östenit (γ-demir) benzer şekilde yumuşak ve metaliktir ancak çok daha fazla karbonu çözebilir (1146 °C'de kütlece %2,04'e kadar). Demirin bu formu çatal-bıçak yapımında kullanılan paslanmaz çelik türünde, hastane ve yemek servisi ekipmanlarında kullanılır. ⓘ
Piyasada bulunan demir, saflık ve katkı maddelerinin bolluğuna göre sınıflandırılır. Pik demir %3,5-4,5 karbon içerir ve değişen miktarlarda kükürt, silikon ve fosfor gibi kirletici maddeler içerir. Pik demir satılabilir bir ürün olmayıp, dökme demir ve çelik üretiminde bir ara adımdır. Pik demirdeki kükürt ve fosfor gibi malzeme özelliklerini olumsuz etkileyen kirleticilerin azaltılmasıyla %2-4 karbon, %1-6 silikon ve az miktarda manganez içeren dökme demir elde edilir. Pik demirin erime noktası 1420-1470 K aralığında olup, iki ana bileşeninden daha düşüktür ve karbon ile demir birlikte ısıtıldığında eriyen ilk üründür. Mekanik özellikleri büyük ölçüde değişkenlik gösterir ve karbonun alaşım içinde aldığı forma bağlıdır. ⓘ
"Beyaz" dökme demirler karbonlarını sementit veya demir karbür (Fe3C) şeklinde içerir. Bu sert, kırılgan bileşik beyaz dökme demirlerin mekanik özelliklerine hakimdir ve onları sert ancak darbelere karşı dayanıksız hale getirir. Beyaz dökme demirin kırılmış yüzeyi, çok soluk, gümüşi, parlak bir malzeme olan kırılmış demir karbürün ince fasetleriyle doludur, bu nedenle bu isim verilmiştir. 0,8 karbonlu bir demir karışımının 723 °C'nin altında yavaşça oda sıcaklığına soğutulması, yumuşak ve dövülebilir olan ve görünümü nedeniyle perlit olarak adlandırılan ayrı, dönüşümlü sementit ve α-demir katmanlarıyla sonuçlanır. Öte yandan hızlı soğutma bu ayrışmaya zaman tanımaz ve sert ve kırılgan martenzit oluşturur. Daha sonra çelik, perlit ve martenzit oranlarını değiştirecek şekilde arada bir sıcaklığa kadar yeniden ısıtılarak temperlenebilir. Son ürün %0,8 karbon içeriğinin altında perlit-αFe karışımı, %0,8 karbon içeriğinin üzerinde ise perlit-sementit karışımıdır. ⓘ
Gri demirde karbon ayrı, ince grafit pulları olarak bulunur ve ayrıca malzeme içinde gerilim yoğunlaşma bölgeleri oluşturan keskin kenarlı grafit pulları nedeniyle malzemeyi kırılgan hale getirir. Sünek demir olarak adlandırılan daha yeni bir gri demir çeşidi, grafitin şeklini sferoidlere veya nodüllere dönüştürmek için eser miktarda magnezyum ile özel olarak işlenir, böylece stres konsantrasyonları azalır ve malzemenin tokluğu ve mukavemeti büyük ölçüde artar. ⓘ
Dövme demir %0,25'ten daha az karbon içerir, ancak ona lifli bir özellik veren büyük miktarda cüruf içerir. Sert, dövülebilir bir üründür, ancak pik demir kadar eriyebilir değildir. Bir kenara honlanırsa, keskinliğini çabucak kaybeder. Dövme demir, metalin içine hapsolmuş ince cüruf liflerinin varlığı ile karakterize edilir. Dövme demir korozyona karşı çelikten daha dayanıklıdır. Geleneksel "dövme demir" ürünlerinde ve demircilikte neredeyse tamamen yumuşak çelikle yer değiştirmiştir. ⓘ
Yumuşak çelik, dövme demirden daha kolay korozyona uğrar, ancak daha ucuzdur ve daha yaygın olarak bulunur. Karbon çeliği, az miktarda manganez, kükürt, fosfor ve silikon ile birlikte %2,0 veya daha az karbon içerir. Alaşımlı çelikler değişen miktarlarda karbonun yanı sıra krom, vanadyum, molibden, nikel, tungsten vb. gibi diğer metalleri de içerir. Alaşım içerikleri maliyetlerini yükseltir ve bu nedenle genellikle yalnızca özel kullanımlar için kullanılırlar. Yine de yaygın bir alaşımlı çelik paslanmaz çeliktir. Demir metalürjisindeki son gelişmeler, 'HSLA' veya yüksek mukavemetli, düşük alaşımlı çelikler olarak da adlandırılan, minimum maliyetle yüksek mukavemet ve genellikle olağanüstü tokluk üretmek için küçük eklemeler içeren, giderek artan bir mikro alaşımlı çelik yelpazesi üretmiştir. ⓘ
Yüksek saflıkta element yapısına sahip alaşımlar (elektrolitik demir alaşımları gibi) süneklik, çekme mukavemeti, tokluk, yorulma mukavemeti, ısı direnci ve korozyon direnci gibi özellikle geliştirilmiş özelliklere sahiptir. ⓘ
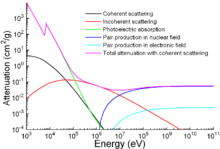
Geleneksel uygulamaların yanı sıra demir, iyonlaştırıcı radyasyondan korunmak için de kullanılır. Diğer bir geleneksel koruma malzemesi olan kurşundan daha hafif olmasına rağmen, mekanik olarak çok daha güçlüdür. Enerjinin bir fonksiyonu olarak radyasyonun zayıflaması grafikte gösterilmiştir. ⓘ
Demir ve çeliğin en büyük dezavantajı, saf demirin ve alaşımlarının çoğunun bir şekilde korunmadığı takdirde paslanmaya maruz kalması ve bu durumun dünya ekonomisinin %1'inden fazlasına mal olmasıdır. Boyama, galvanizleme, pasivasyon, plastik kaplama ve mavileştirme, su ve oksijeni dışarıda bırakarak veya katodik koruma yoluyla demiri pastan korumak için kullanılır. Demirin paslanma mekanizması aşağıdaki gibidir:
- Katot: 3 O2 + 6 H2O + 12 e- → 12 OH-
- Anot: 4 Fe → 4 Fe2+ + 8 e-; 4 Fe2+ → 4 Fe3+ + 4 e-
- Genel: 4 Fe + 3 O2 + 6 H2O → 4 Fe3+ + 12 OH- → 4 Fe(OH)3 veya 4 FeO(OH) + 4 H2O ⓘ
Elektrolit genellikle kentsel alanlarda demir(II) sülfat (atmosferik sülfür dioksit demire saldırdığında oluşur) ve deniz kenarındaki alanlarda atmosferdeki tuz parçacıklarıdır. ⓘ
Demir bileşikleri
Demirin baskın kullanımı metalürjide olsa da, demir bileşikleri endüstride de yaygındır. Demir katalizörler geleneksel olarak amonyak üretimi için Haber-Bosch prosesinde ve karbon monoksitin yakıtlar ve yağlayıcılar için hidrokarbonlara dönüştürülmesi için Fischer-Tropsch prosesinde kullanılmaktadır. Asidik bir çözücü içinde toz haline getirilmiş demir, nitrobenzenin aniline indirgenmesinde Bechamp indirgemesinde kullanılmıştır. Demir bazlı katalizörler, biyobazlı hammaddelerin değerli dökme ve ince kimyasallara dönüştürülmesinde, yakıt hücrelerinde ve tehlikeli kimyasalların giderilmesinde önemli bir rol oynamaktadır. ⓘ
Alüminyum tozu ile karıştırılan demir (III) oksit, termit reaksiyonu oluşturmak için ateşlenebilir, büyük demir parçaların (raylar gibi) kaynağında ve cevherlerin saflaştırılmasında kullanılır. Demir (III) oksit ve oksihidroksit kırmızımsı ve koyu sarı pigmentler olarak kullanılır. ⓘ
Demir (III) klorür, su arıtma ve kanalizasyon arıtmada, kumaş boyamada, boyalarda renklendirici olarak, hayvan yemlerinde katkı maddesi olarak ve baskılı devre kartlarının üretiminde bakır için aşındırıcı olarak kullanılır. Ayrıca kanaryalarda kanamayı durdurmak için ilaç olarak kullanılan demir tentürü oluşturmak için alkolde çözülebilir. ⓘ
Demir (II) sülfat diğer demir bileşiklerinin öncüsü olarak kullanılır. Ayrıca çimentodaki kromatı azaltmak için de kullanılır. Gıdaları güçlendirmek ve demir eksikliği anemisini tedavi etmek için kullanılır. Demir(III) sülfat, tank suyundaki küçük kanalizasyon partiküllerinin çökeltilmesinde kullanılır. Demir (II) klorür, indirgeyici bir topaklaştırıcı madde olarak, demir kompleksleri ve manyetik demir oksitlerin oluşumunda ve organik sentezde indirgeyici bir madde olarak kullanılır. ⓘ
Biyolojik ve patolojik rolü
Demir yaşam için gereklidir. Demir-sülfür kümeleri yaygındır ve biyolojik azot fiksasyonundan sorumlu enzimler olan nitrojenazı içerir. Demir içeren proteinler oksijenin taşınması, depolanması ve kullanılmasına katılır. Demir proteinleri elektron transferinde rol oynar. ⓘ

Yüksek organizmalarda demir içeren proteinlere örnek olarak hemoglobin, sitokrom (bkz. yüksek değerlikli demir) ve katalaz verilebilir. Ortalama bir yetişkin insan vücut ağırlığının yaklaşık %0,005'i ya da dörtte üçü hemoglobinde olmak üzere yaklaşık dört gram demir içerir - bu seviye her gün sadece bir miligram demir emilmesine rağmen sabit kalır, çünkü insan vücudu demir içeriği için hemoglobini geri dönüştürür. ⓘ
Mikrobiyal büyüme, demirin (II) oksidasyonu veya demirin (III) indirgenmesi ile desteklenebilir. ⓘ
Biyokimya
Demir alımı aerobik organizmalar için bir sorun teşkil eder çünkü ferrik demir nötr pH yakınlarında çok az çözünür. Bu nedenle, bu organizmalar demiri kompleksler halinde absorbe etmek için araçlar geliştirmişlerdir, bazen ferrik demiri tekrar ferrik demire oksitlemeden önce alırlar. Özellikle bakteriler, siderofor adı verilen çok yüksek afiniteli tutucu maddeler geliştirmiştir. ⓘ
İnsan hücrelerinde alımdan sonra, demir depolanması hassas bir şekilde düzenlenir. Bu düzenlemenin önemli bir bileşeni, duodenumdan emilen demir iyonlarını bağlayan ve kanda hücrelere taşıyan protein transferrindir. Transferrin, bir azot, üç oksijen ve Fe3+ iyonunu hapseden şelatlayıcı bir karbonat anyonuna bağlı, çarpık bir oktahedronun ortasında Fe3+ içerir: o kadar yüksek bir stabilite sabitine sahiptir ki, en stabil komplekslerden bile Fe3+ iyonlarını almada çok etkilidir. Kemik iliğinde, transferrin Fe3+ ve Fe2+ 'den indirgenir ve hemoglobine dahil edilmek üzere ferritin olarak depolanır. ⓘ
En yaygın olarak bilinen ve üzerinde çalışılan biyoinorganik demir bileşikleri (biyolojik demir molekülleri) hem proteinleridir: örnekler hemoglobin, miyoglobin ve sitokrom P450'dir. Bu bileşikler gazların taşınmasına, enzimlerin oluşturulmasına ve elektronların transferine katılır. Metaloproteinler, metal iyonu kofaktörleri olan bir grup proteindir. Demir metaloproteinlerine örnek olarak ferritin ve rubredoksin verilebilir. Katalaz, lipoksijenazlar ve IRE-BP gibi yaşam için hayati önem taşıyan birçok enzim demir içerir. ⓘ
Hemoglobin, kırmızı kan hücrelerinde bulunan ve renklerine katkıda bulunan bir oksijen taşıyıcısıdır, oksijeni arterlerde akciğerlerden kaslara taşır ve burada glikozun metabolik oksidasyonu için gerekli olana kadar depolayarak enerji üreten miyoglobine aktarılır. Burada hemoglobin, glikoz oksitlendiğinde ortaya çıkan ve hemoglobin tarafından damarlar yoluyla (ağırlıklı olarak bikarbonat anyonları olarak) nefes verildiği akciğerlere geri taşınan karbondioksite bağlanır. Hemoglobinde demir dört hem grubundan birinde bulunur ve altı olası koordinasyon bölgesine sahiptir; dördü bir porfirin halkasındaki nitrojen atomları tarafından, beşincisi hem grubuna bağlı protein zincirlerinden birinin histidin kalıntısındaki bir imidazol nitrojeni tarafından işgal edilir ve altıncısı geri dönüşümlü olarak bağlanabileceği oksijen molekülü için ayrılmıştır. Hemoglobin oksijene bağlı olmadığında (ve deoksihemoglobin olarak adlandırıldığında), hem grubunun merkezindeki (hidrofobik protein iç kısmında) Fe2+ iyonu yüksek spinli bir konfigürasyondadır. Bu nedenle porfirin halkasının içine sığamayacak kadar büyüktür ve bunun yerine Fe2+ iyonu yaklaşık 55 pikometre yukarıda olacak şekilde bir kubbe şeklinde bükülür. Bu konfigürasyonda, oksijen için ayrılan altıncı koordinasyon bölgesi başka bir histidin kalıntısı tarafından bloke edilir. ⓘ
Deoksihemoglobin bir oksijen molekülü aldığında, bu histidin kalıntısı uzaklaşır ve oksijen onunla bir hidrojen bağı oluşturmak için güvenli bir şekilde bağlandığında geri döner. Bunun sonucunda Fe2+ iyonu düşük spinli bir konfigürasyona geçerek iyonik yarıçapta %20'lik bir azalmaya neden olur, böylece artık düzlemsel hale gelen porfirin halkasına sığabilir. (Ek olarak, bu hidrojen bağı oksijen molekülünün eğilmesine neden olarak yaklaşık 120°'lik bir Fe-O-O bağ açısıyla sonuçlanır ve bu da elektron transferine, Fe2+'nin Fe3+'e oksidasyonuna ve hemoglobinin yıkımına yol açacak Fe-O-Fe veya Fe-O2-Fe köprülerinin oluşumunu önler). Bu, hemoglobinin diğer alt birimlerinin daha büyük oksijen afinitesine sahip bir şekle dönüşmesine yol açan tüm protein zincirlerinin hareketiyle sonuçlanır. Böylece, deoksihemoglobin oksijen aldığında, daha fazla oksijene olan ilgisi artar ve bunun tersi de geçerlidir. Öte yandan miyoglobin sadece bir hem grubu içerir ve dolayısıyla bu kooperatif etki meydana gelemez. Bu nedenle, hemoglobin akciğerlerde bulunan yüksek kısmi oksijen basınçlarında neredeyse oksijene doymuş olsa da, oksijene olan ilgisi, kas dokusunda bulunan düşük kısmi oksijen basınçlarında bile oksijenlenen miyoglobininkinden çok daha düşüktür. Bohr etkisi (adını Niels Bohr'un babası Christian Bohr'dan almıştır) ile tanımlandığı üzere, hemoglobinin oksijene olan ilgisi karbondioksit varlığında azalır. ⓘ

Karbon monoksit ve fosfor triflorür insanlar için zehirlidir, çünkü hemoglobine oksijene benzer şekilde, ancak çok daha güçlü bir şekilde bağlanırlar, böylece oksijen artık vücutta taşınamaz. Karbon monoksite bağlı hemoglobin karboksihemoglobin olarak bilinir. Bu etki siyanürün toksisitesinde de küçük bir rol oynar, ancak burada en büyük etki elektron taşıma proteini sitokrom a'nın düzgün çalışmasını engellemesidir. Sitokrom proteinleri de hem grupları içerir ve glikozun oksijenle metabolik oksidasyonuna katılır. Altıncı koordinasyon bölgesi ya başka bir imidazol azotu ya da bir metiyonin sülfür tarafından işgal edilir, böylece bu proteinler oksijene karşı büyük ölçüde etkisizdir - doğrudan oksijene bağlanan ve bu nedenle siyanür tarafından çok kolay zehirlenen sitokrom a hariç. Burada elektron transferi, demir düşük spinde kalırken ancak +2 ve +3 oksidasyon durumları arasında değişirken gerçekleşir. Her adımın indirgeme potansiyeli bir öncekinden biraz daha büyük olduğundan, enerji adım adım serbest bırakılır ve böylece adenozin trifosfatta depolanabilir. Sitokrom a, mitokondriyal membranda meydana geldiği, doğrudan oksijene bağlandığı ve aşağıdaki gibi elektronların yanı sıra protonları da taşıdığı için biraz farklıdır:
- 4 Cytc2+ + O2 + 8H+
iç → 4 Cytc3+ + 2 H2O + 4H+
Dışarıda ⓘ
Hem proteinleri demir içeren proteinlerin en önemli sınıfı olmasına rağmen, demir-sülfür proteinleri de çok önemlidir, elektron transferinde yer alırlar, bu da demirin +2 veya +3 oksidasyon durumlarında kararlı bir şekilde var olabilmesi nedeniyle mümkündür. Bunların her biri dört kükürt atomuna yaklaşık olarak tetrahedral olarak koordine edilmiş bir, iki, dört veya sekiz demir atomuna sahiptir; bu tetrahedral koordinasyon nedeniyle her zaman yüksek spinli demire sahiptirler. Bu tür bileşiklerin en basiti, çevresindeki peptit zincirlerindeki sistein kalıntılarından gelen dört sülfür atomuna koordine edilmiş yalnızca bir demir atomuna sahip olan rubredoksindir. Demir-sülfür proteinlerinin bir diğer önemli sınıfı ise birden fazla demir atomuna sahip olan ferredoksinlerdir. Transferrin bu iki sınıfa da ait değildir. ⓘ
Deniz midyelerinin okyanustaki kayalara tutunabilmeleri, protein açısından zengin kütiküllerinde organometalik demir bazlı bağlar kullanmaları sayesinde kolaylaşır. Sentetik kopyalara dayanarak, bu yapılardaki demirin varlığı elastik modülü 770 kat, gerilme mukavemetini 58 kat ve tokluğu 92 kat artırmıştır. Kalıcı olarak hasar görmeleri için gereken stres miktarı ise 76 kat artmıştır. ⓘ
Beslenme
Diyet
Demir her yerde bulunur, ancak özellikle zengin diyet demir kaynakları arasında kırmızı et, istiridye, mercimek, fasulye, kümes hayvanları, balık, yaprak sebzeler, su teresi, tofu, nohut, börülce ve kara üzüm pekmezi yer alır. Ekmek ve kahvaltılık tahıllar bazen özel olarak demir ile takviye edilir. ⓘ
Diyet takviyeleri ile sağlanan demir genellikle demir (II) fumarat olarak bulunur, ancak demir (II) sülfat daha ucuzdur ve eşit derecede iyi emilir. Elemental demir veya indirgenmiş demir, sadece üçte bir ila üçte iki oranında emilmesine rağmen (demir sülfata göre), genellikle kahvaltılık tahıllar veya zenginleştirilmiş buğday unu gibi gıdalara eklenir. Demir, amino asitlere şelatlandığında vücut tarafından en iyi şekilde kullanılabilir ve yaygın bir demir takviyesi olarak da kullanılabilir. En ucuz amino asit olan glisin, çoğunlukla demir glisinat takviyeleri üretmek için kullanılır. ⓘ
Diyet önerileri
ABD Tıp Enstitüsü (IOM) 2001 yılında demir için Tahmini Ortalama Gereksinimleri (EAR'lar) ve Önerilen Diyet Miktarlarını (RDA'lar) güncellemiştir. Demir için mevcut EAR 14-18 yaş arası kadınlar için 7.9 mg/gün, 19-50 yaş arası için 8.1 ve sonrası için (menopoz sonrası) 5.0'dır. Erkekler için EAR 19 yaş ve üstü için 6.0 mg/gün'dür. RDA, 15-18 yaş arası kadınlar için 15,0 mg/gün, 19-50 yaş için 18,0 ve sonrası için 8,0 mg/gündür. Erkekler için 19 yaş ve üzeri için 8,0 mg/gündür. RDA'lar, ortalamadan daha yüksek gereksinimleri olan kişileri kapsayacak miktarları belirlemek için EAR'lardan daha yüksektir. Hamilelik için RDA 27 mg/gün ve emzirme dönemi için 9 mg/gündür. 1-3 yaş arası çocuklar için 7 mg/gün, 4-8 yaş arası için 10 ve 9-13 yaş arası için 8 mg/gündür. Güvenlikle ilgili olarak IOM, kanıtların yeterli olduğu durumlarda vitamin ve mineraller için tolere edilebilir üst alım seviyeleri (UL) de belirlemektedir. Demir söz konusu olduğunda UL 45 mg/gün olarak belirlenmiştir. EAR'lar, RDA'lar ve UL'ler toplu olarak Diyet Referans Alımları olarak adlandırılır. ⓘ
Avrupa Gıda Güvenliği Otoritesi (EFSA), RDA yerine Popülasyon Referans Alımı (PRI) ve EAR yerine Ortalama Gereksinim kullanarak bu toplu bilgi setini Diyet Referans Değerleri olarak adlandırmaktadır. AI ve UL, Amerika Birleşik Devletleri'ndeki ile aynı şekilde tanımlanmıştır. Kadınlar için PRI 15-17 yaş arası 13 mg/gün, 18 yaş ve üstü menopoz öncesi kadınlar için 16 mg/gün ve menopoz sonrası 11 mg/gündür. Hamilelik ve emzirme dönemi için 16 mg/gün. Erkekler için PRI 15 yaş ve üzeri için 11 mg/gün'dür. 1-14 yaş arası çocuklar için PRI 7'den 11 mg/gün'e çıkar. Hamilelik haricinde, PRI'lar ABD RDA'larından daha yüksektir. EFSA aynı güvenlik sorusunu incelemiş ve bir UL belirlememiştir. ⓘ
Bebekler biberonla inek sütü ile besleniyorsa demir takviyesine ihtiyaç duyabilirler. Sık kan verenler düşük demir seviyesi riski altındadır ve genellikle demir alımlarını takviye etmeleri tavsiye edilir. ⓘ
ABD gıda ve besin takviyesi etiketleme amaçları için bir porsiyondaki miktar Günlük Değerin yüzdesi (%DV) olarak ifade edilir. Demir etiketleme amaçları için Günlük Değerin %100'ü 18 mg idi ve 27 Mayıs 2016 itibariyle 18 mg olarak değişmeden kalmıştır. Eski ve yeni yetişkin günlük değerlerinin bir tablosu Referans Günlük Alım adresinde verilmiştir. ⓘ
Eksiklik
Demir eksikliği dünyada en yaygın görülen beslenme eksikliğidir. Demir kaybı diyetle yeterli miktarda demir alımıyla telafi edilemediğinde, gizli demir eksikliği durumu ortaya çıkar ve bu durum tedavi edilmezse zamanla yetersiz sayıda kırmızı kan hücresi ve yetersiz miktarda hemoglobin ile karakterize demir eksikliği anemisine yol açar. Çocuklar, menopoz öncesi kadınlar (doğurganlık çağındaki kadınlar) ve kötü beslenen kişiler hastalığa en yatkın olanlardır. Demir eksikliği anemisi vakalarının çoğu hafiftir, ancak tedavi edilmezse hızlı veya düzensiz kalp atışı, hamilelik sırasında komplikasyonlar ve bebeklerde ve çocuklarda büyümenin gecikmesi gibi sorunlara neden olabilir. ⓘ
Fazla
Demir alımı, demirin atılması için düzenlenmiş fizyolojik bir yolu olmayan insan vücudu tarafından sıkı bir şekilde düzenlenir. Mukozal ve deri epitel hücrelerinin dökülmesi nedeniyle günlük olarak sadece küçük miktarlarda demir kaybedilir, bu nedenle demir seviyelerinin kontrolü öncelikle alımın düzenlenmesi ile gerçekleştirilir. Demir alımının düzenlenmesi, kromozom 6 üzerindeki HLA-H gen bölgesiyle eşleşen ve memelilerde dolaşım sistemine demir girişinin önemli bir düzenleyicisi olan hepsidin seviyelerinin anormal derecede düşük olmasına yol açan genetik bir kusurun sonucu olarak bazı insanlarda bozulur. Bu kişilerde aşırı demir alımı, tıbbi olarak hemokromatoz olarak bilinen aşırı demir yüklenmesi bozukluklarına neden olabilir. Birçok insan aşırı demir yüklemesine karşı teşhis edilmemiş genetik bir yatkınlığa sahiptir ve bu sorunun aile geçmişinden haberdar değildir. Bu nedenle, insanlar demir eksikliğinden muzdarip olmadıkça ve bir doktora danışmadıkça demir takviyesi almamalıdır. Hemokromatozisin Kafkasyalılarda görülen tüm metabolik hastalıkların %0,3 ila %0,8'inin nedeni olduğu tahmin edilmektedir. ⓘ
Aşırı dozda alınan demir, kanda aşırı serbest demir seviyelerine neden olabilir. Yüksek kan serbest demir seviyeleri peroksitlerle reaksiyona girerek DNA'ya, proteinlere, lipitlere ve diğer hücresel bileşenlere zarar verebilecek yüksek reaktif serbest radikaller üretir. Demir toksisitesi, hücre serbest demir içerdiğinde ortaya çıkar; bu da genellikle demir seviyeleri demiri bağlamak için transferrin kullanılabilirliğini aştığında meydana gelir. Gastrointestinal sistem hücrelerinin hasar görmesi de demir emilimini düzenlemelerini engelleyerek kan seviyelerinde daha fazla artışa yol açabilir. Demir tipik olarak kalp, karaciğer ve başka yerlerdeki hücrelere zarar vererek koma, metabolik asidoz, şok, karaciğer yetmezliği, koagülopati, uzun süreli organ hasarı ve hatta ölüm gibi olumsuz etkilere neden olur. İnsanlar, demir vücut kütlesinin her kilogramı için 20 miligramı aştığında demir toksisitesi yaşar; kilogram başına 60 miligram ölümcül bir doz olarak kabul edilir. Genellikle çocukların yetişkinlerin tüketimine yönelik demir sülfat tabletlerinden çok miktarda yemesi sonucu ortaya çıkan aşırı demir tüketimi, altı yaşın altındaki çocuklarda en yaygın toksikolojik ölüm nedenlerinden biridir. Diyet Referans Alımı (DRI) yetişkinler için Tolere Edilebilir Üst Alım Seviyesini (UL) 45 mg/gün olarak belirlemiştir. On dört yaşın altındaki çocuklar için UL 40 mg/gün'dür. ⓘ
Demir toksisitesinin tıbbi yönetimi karmaşıktır ve fazla demiri bağlamak ve vücuttan atmak için deferoksamin adı verilen özel bir şelatlama maddesinin kullanılmasını içerebilir. ⓘ
DEHB
Bazı araştırmalar, düşük talamik demir seviyelerinin DEHB'nin patofizyolojisinde rol oynayabileceğini öne sürmüştür. Bazı araştırmacılar demir takviyesinin özellikle bozukluğun dikkatsiz alt tipinde etkili olabileceğini bulmuşlardır. Ayrıca, araştırmalar demirin DEHB ilaçlarıyla tedavi sırasında kardiyovasküler olay riskini azaltma potansiyeline sahip olduğunu veya daha düşük dozda psikostimülanlara yanıtı optimize etmek için bir müdahale olarak kullanılabileceğini göstermiştir. ⓘ
Kanser
Demirin kanser savunmasındaki rolü, patolojik olmayan süreçlerdeki yaygın varlığı nedeniyle "iki ucu keskin kılıç" olarak tanımlanabilir. Kemoterapi gören kişilerde demir eksikliği ve anemi gelişebilir, bunun için demir seviyelerini düzeltmek için intravenöz demir tedavisi kullanılır. Yüksek miktarda kırmızı et tüketiminden kaynaklanabilecek aşırı demir yüklemesi, tümör büyümesini başlatabilir ve özellikle kolorektal kanser için kanser başlangıcına yatkınlığı artırabilir. ⓘ
Deniz sistemleri
Demir, deniz sistemlerinde önemli bir rol oynar ve planktonik aktivite için sınırlayıcı bir besin maddesi olarak hareket edebilir. Bu nedenle, demirdeki çok fazla azalma, diyatomlar gibi fitoplanktonik organizmalarda büyüme oranlarının düşmesine neden olabilir. Demir, demirin yüksek ve oksijenin düşük olduğu koşullar altında deniz mikropları tarafından da oksitlenebilir. ⓘ
Demir, deniz sistemlerine bitişik nehirler yoluyla ve doğrudan atmosferden girebilir. Demir okyanusa girdikten sonra, okyanus karışımı ve hücresel düzeyde geri dönüşüm yoluyla su sütunu boyunca dağıtılabilir. Kuzey Kutbu'nda deniz buzu, okyanustaki demirin depolanması ve dağıtılmasında önemli bir rol oynar, kışın donarken okyanus demirini tüketir ve yaz aylarında çözülme meydana geldiğinde suya geri bırakır. Demir döngüsü, demirin birincil üreticiler için kullanılabilirliğini değiştirerek sulu formdan partikül formuna kadar demir formlarını dalgalandırabilir. Artan ışık ve sıcaklık, birincil üreticiler tarafından kullanılabilecek formlardaki demir miktarını artırır. ⓘ
Bulunuşu
Demir uzayda en çok bulunan elementlerden birisi olup yerkabuğunda %5,06 oranında bulunur. Genel olarak yerkabuğunda bulunan demir filizleri (cevherleri) hematit, limonit, götit, magnetit, siderit ve pirittir. Dünyanın çekirdeğinin de büyük oranda metalik demir-nikel alaşımından meydana geldiği tahmin edilmektedir. ⓘ
Manyetit minerali ⓘ
Demir cevheri
Demir madenlerinden çıkarılan demir cevherlerini izabeye uygun hale getirmek için yüksek tenörlü ve düşük tenörlü cevherler için yapılan işlemler olmak üzere iki gruba ayrılırlar. Yüksek tenörlü cevherler için sadece boyut küçültme işlemine prosesine tabi tutulurlar. Düşük tenörlü cevherler ise gravite ayırma, manyetik ayırma, flotasyon, elektrostatik ayırma, yıkama, kalsinasyon, liç, seçimli salkımlaştırma gibi yöntemler kullanılarak hazırlanırlar. ⓘ
Demir ve insan vücudu
Demir, bakır ve kalsiyum gibi bazı minerallerin emilimi ve kanda oksijeni taşıyan kırmızı kan hücrelerinin ve çeşitli enzimlerin üretimi için gereklidir. Ayrıca, bağışıklık sistemini de güçlendirir. ⓘ
Besin maddeleri ve suda bulunur. Toprakda da bol miktarda demir bileşikleri bulunur. Bitkiler demiri topraktan, hayvan ve insan organizması da bitkilerden alır. Günlük ihtiyaç 8 – 10 mg kadardır. Bu miktar gebelik, emzirme ve adet dönemlerindeki kadınlarda biraz daha fazladır. Demir için en iyi kaynaklar karaciğer, böbrek, kalp, sakatatlar, yumurta sarısı, balık, istiridye, fasulye, ıspanak, buğday ve yulaf unu, hurma, ceviz, fındık, kuru kayısı ve pekmezdir. ⓘ
Organizmada hemoglobin, miyoglobin, solunum enzimlerinde bulunur. Besinlerde Fe3+ şeklinde bulunur. ⓘ
- Etlerde porfirin sisteminde kompleks halde
- Sebzelerde anorganik demir halinde
- Hayvan ve insan organizmasında ise iyonlaşan demir halinde bulunur. ⓘ
Demir eksikliğine, Demir Eksikliği anemisi (kansızlık) denir. ⓘ