Titanyum
 | ||||||||||||||||||||||||||||||||||||||
| Titanyum | ||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Telaffuz |
| |||||||||||||||||||||||||||||||||||||
| Görünüş | gümüşi gri-beyaz metalik | |||||||||||||||||||||||||||||||||||||
| Standart atom ağırlığı Ar°(Ti) |
| |||||||||||||||||||||||||||||||||||||
| Periyodik tabloda titanyum | ||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||
| Atom numarası (Z) | 22 | |||||||||||||||||||||||||||||||||||||
| Grup | Grup 4 | |||||||||||||||||||||||||||||||||||||
| Dönem | dönem 4 | |||||||||||||||||||||||||||||||||||||
| Blok | d-blok | |||||||||||||||||||||||||||||||||||||
| Elektron konfigürasyonu | [[[Argon|Ar]]] 3d2 4s2 | |||||||||||||||||||||||||||||||||||||
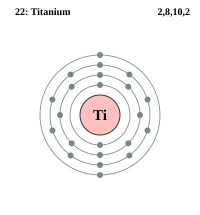
| Kabuk başına elektron | 2, 8, 10, 2 | |||||||||||||||||||||||||||||||||||||
| Fiziksel özellikler | ||||||||||||||||||||||||||||||||||||||
| STP'de Faz | katı | |||||||||||||||||||||||||||||||||||||
| Erime noktası | 1941 K (1668 °C, 3034 °F) | |||||||||||||||||||||||||||||||||||||
| Kaynama noktası | 3560 K (3287 °C, 5949 °F) | |||||||||||||||||||||||||||||||||||||
| Yoğunluk (r.t.'ye yakın) | 4,506 g/cm3 | |||||||||||||||||||||||||||||||||||||
| sıvı olduğunda (m.p.'de) | 4,11 g/cm3 | |||||||||||||||||||||||||||||||||||||
| Füzyon ısısı | 14,15 kJ/mol | |||||||||||||||||||||||||||||||||||||
| Buharlaşma ısısı | 425 kJ/mol | |||||||||||||||||||||||||||||||||||||
| Molar ısı kapasitesi | 25.060 J/(mol-K) | |||||||||||||||||||||||||||||||||||||
Buhar basıncı
| ||||||||||||||||||||||||||||||||||||||
| Atomik özellikler | ||||||||||||||||||||||||||||||||||||||
| Oksidasyon durumları | -2, -1, 0, +1, +2, +3, +4 (amfoterik bir oksit) | |||||||||||||||||||||||||||||||||||||
| Elektronegatiflik | Pauling ölçeği: 1.54 | |||||||||||||||||||||||||||||||||||||
| İyonlaşma enerjileri |
| |||||||||||||||||||||||||||||||||||||
| Atomik yarıçap | ampi̇ri̇k: 147 pm | |||||||||||||||||||||||||||||||||||||
| Kovalent yarıçap | 160±8 pm | |||||||||||||||||||||||||||||||||||||
| Titanyumun spektral çizgileri | ||||||||||||||||||||||||||||||||||||||
| Diğer özellikler | ||||||||||||||||||||||||||||||||||||||
| Doğal oluşum | ilkel | |||||||||||||||||||||||||||||||||||||
| Kristal yapı | altıgen yakın paketlenmiş (hcp) | |||||||||||||||||||||||||||||||||||||
| Ses hızı ince çubuk | 5090 m/s (r.t.'de) | |||||||||||||||||||||||||||||||||||||
| Termal genleşme | 8,6 µm/(m⋅K) (25 °C'de) | |||||||||||||||||||||||||||||||||||||
| Termal iletkenlik | 21,9 W/(m⋅K) | |||||||||||||||||||||||||||||||||||||
| Elektriksel direnç | 420 nΩ⋅m (20 °C'de) | |||||||||||||||||||||||||||||||||||||
| Manyetik sıralama | paramanyetik | |||||||||||||||||||||||||||||||||||||
| Molar manyetik duyarlılık | +153,0×10-6 cm3/mol (293 K) | |||||||||||||||||||||||||||||||||||||
| Young modülü | 116 GPa | |||||||||||||||||||||||||||||||||||||
| Kayma modülü | 44 GPa | |||||||||||||||||||||||||||||||||||||
| Yığın modülü | 110 GPa | |||||||||||||||||||||||||||||||||||||
| Poisson oranı | 0.32 | |||||||||||||||||||||||||||||||||||||
| Mohs sertliği | 6.0 | |||||||||||||||||||||||||||||||||||||
| Vickers sertliği | 830-3420 MPa | |||||||||||||||||||||||||||||||||||||
| Brinell sertliği | 716-2770 MPa | |||||||||||||||||||||||||||||||||||||
| CAS Numarası | 7440-32-6 | |||||||||||||||||||||||||||||||||||||
| Tarih | ||||||||||||||||||||||||||||||||||||||
| Keşif | William Gregor (1791) | |||||||||||||||||||||||||||||||||||||
| İlk izolasyon | Jöns Jakob Berzelius (1825) | |||||||||||||||||||||||||||||||||||||
| İsimlendiren | Martin Heinrich Klaproth (1795) | |||||||||||||||||||||||||||||||||||||
| Titanyumun ana izotopları | ||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||
Titanyum, Ti sembolüne ve 22 atom numarasına sahip kimyasal bir elementtir. Doğada sadece oksit olarak bulunur, indirgenerek gümüş renginde, düşük yoğunluklu ve yüksek mukavemetli, deniz suyunda, aqua regia'da ve klorda korozyona dayanıklı parlak bir geçiş metali üretilebilir. ⓘ
Titanyum, 1791 yılında William Gregor tarafından Cornwall, Büyük Britanya'da keşfedilmiş ve Martin Heinrich Klaproth tarafından Yunan mitolojisindeki Titanların adını almıştır. Element, başta rutil ve ilmenit olmak üzere Dünya'nın kabuğunda ve litosferinde yaygın olarak bulunan bir dizi mineral yatağında oluşur; neredeyse tüm canlıların yanı sıra su kütlelerinde, kayalarda ve toprakta bulunur. Metal, başlıca mineral cevherlerinden Kroll ve Hunter süreçleri ile çıkarılır. En yaygın bileşik olan titanyum dioksit, popüler bir fotokatalizördür ve beyaz pigmentlerin üretiminde kullanılır. Diğer bileşikler arasında duman perdelerinin ve katalizörlerin bir bileşeni olan titanyum tetraklorür (TiCl4) ve polipropilen üretiminde katalizör olarak kullanılan titanyum triklorür (TiCl3) bulunur. ⓘ
Titanyum, havacılık (jet motorları, füzeler ve uzay araçları), askeri, endüstriyel süreçler (kimyasallar ve petrokimyasallar, tuzdan arındırma tesisleri, kağıt hamuru ve kağıt), otomotiv, tarım (çiftçilik), tıbbi protezler, ortopedik implantlar, diş ve endodontik aletler ve eğeler, diş implantları, spor malzemeleri, mücevherler, cep telefonları ve diğer uygulamalar için güçlü, hafif alaşımlar üretmek üzere diğer elementlerin yanı sıra demir, alüminyum, vanadyum ve molibden ile alaşım haline getirilebilir. ⓘ
Metalin en kullanışlı iki özelliği korozyon direnci ve herhangi bir metalik elementin en yükseği olan mukavemet-yoğunluk oranıdır. Alaşımsız haliyle titanyum bazı çelikler kadar güçlüdür, ancak daha az yoğundur. Bu elementin iki allotropik formu ve doğal olarak oluşan beş izotopu vardır, 46Ti ile 50Ti arasında, 48Ti en bol olanıdır (%73,8). ⓘ
Özellikleri
Fiziksel özellikler
Bir metal olarak titanyum, yüksek mukavemet/ağırlık oranıyla tanınır. Oldukça sünek (özellikle oksijensiz ortamda), parlak ve metalik-beyaz renkli, düşük yoğunluklu güçlü bir metaldir. Nispeten yüksek erime noktası (1,668 °C veya 3,034 °F) onu refrakter bir metal olarak kullanışlı kılar. Paramanyetiktir ve diğer metallere kıyasla oldukça düşük elektrik ve ısı iletkenliğine sahiptir. Titanyum, kritik sıcaklığı olan 0,49 K'nin altına soğutulduğunda süper iletkendir. ⓘ
Ticari olarak saf (%99,2 saf) titanyum kaliteleri, yaklaşık 434 MPa (63.000 psi) nihai gerilme mukavemetine sahiptir, bu da yaygın, düşük dereceli çelik alaşımlarınınkine eşittir, ancak daha az yoğundur. Titanyum alüminyumdan %60 daha yoğundur, ancak en yaygın olarak kullanılan 6061-T6 alüminyum alaşımından iki kat daha güçlüdür. Bazı titanyum alaşımları (örneğin Beta C) 1.400 MPa'nın (200.000 psi) üzerinde gerilme mukavemetine ulaşır. Ancak titanyum 430 °C'nin (806 °F) üzerinde ısıtıldığında gücünü kaybeder. ⓘ
Titanyum, bazı ısıl işlem görmüş çelik sınıfları kadar sert değildir; manyetik değildir ve zayıf bir ısı ve elektrik iletkenidir. Keskin aletler ve uygun soğutma yöntemleri kullanılmadığı sürece malzeme safra yapabileceğinden, işleme önlemler gerektirir. Çelik yapılar gibi, titanyumdan yapılanlar da bazı uygulamalarda uzun ömürlülüğü garanti eden bir yorulma sınırına sahiptir. ⓘ
Metal, 882 °C'de (1.620 °F) gövde merkezli kübik (kafes) β formuna dönüşen altıgen α formunun dimorfik bir allotropudur. Bu geçiş sıcaklığına kadar ısıtıldığında α formunun özgül ısısı önemli ölçüde artar, ancak daha sonra düşer ve sıcaklıktan bağımsız olarak β formu için oldukça sabit kalır. ⓘ
Zirkonyum ve hafniyuma benzer şekilde, ekstra bir omega fazı vardır, bu faz yüksek basınçlarda termodinamiksel olarak kararlıdır ancak normal basınçta yarı kararlı olabilir. ⓘ
Kimyasal özellikler

Alüminyum ve magnezyum gibi, titanyum metali ve alaşımlarının yüzeyi de havaya maruz kaldıktan hemen sonra oksitlenerek metali daha fazla oksidasyon veya korozyondan koruyan ince, gözeneksiz bir pasivasyon tabakası oluşturur. İlk oluştuğunda, bu koruyucu tabaka sadece 1-2 nm kalınlığındadır, ancak yavaşça büyümeye devam ederek dört yıl içinde 25 nm kalınlığa ulaşır. Bu tabaka titanyuma korozyona karşı neredeyse platine eşdeğer mükemmel bir direnç kazandırır. ⓘ
Titanyum seyreltik sülfürik ve hidroklorik asitlerin, klorür çözeltilerinin ve çoğu organik asidin saldırısına dayanabilir. Bununla birlikte, titanyum konsantre asitler tarafından aşındırılır. Negatif redoks potansiyelinin de gösterdiği gibi, titanyum termodinamik olarak çok reaktif bir metaldir ve normal atmosferde erime noktasından daha düşük sıcaklıklarda yanar. Erime sadece inert bir atmosferde veya vakumda mümkündür. 550 °C'de (1,022 °F) klor ile birleşir. Ayrıca diğer halojenlerle reaksiyona girer ve hidrojeni absorbe eder. ⓘ
Titanyum havada 1.200 °C'de (2.190 °F) ve saf oksijende 610 °C'de (1.130 °F) oksijenle kolayca reaksiyona girerek titanyum dioksit oluşturur. Titanyum, saf nitrojen gazında yanan birkaç elementten biridir ve 800 °C'de (1.470 °F) reaksiyona girerek titanyum nitrür oluşturur ve bu da gevrekleşmeye neden olur. Oksijen, nitrojen ve diğer birçok gazla yüksek reaktivitesi nedeniyle, filamentlerden buharlaştırılan titanyum, titanyumun kimyasal olarak bağlanarak bu gazlar için bir tutucu görevi gördüğü titanyum süblimasyon pompalarının temelini oluşturur. Bu tür pompalar ultra yüksek vakum sistemlerinde son derece düşük basınçları ucuza üretir. ⓘ
Titanyumun en ünlü kimyasal özelliği korozyona karşı gösterdiği müthiş direncidir. Neredeyse platin kadar dirençli olan element asitler, klor gazı ve yaygın tuz çözeltilerinin maruziyetine karşı koyabilecek yeterliliktedir. Saf titanyum su içerisinde çözünmez ancak yoğun asit içinde çözünebilir. ⓘ
Pourbaix diagramı titanyumun termodinamik olarak çok reaktif bir metal olduğunu gösterir. Titanyumun su ve hava tepkimesi yavaştır. ⓘ
Deneyler doğal titanyum döteron ile bombardıman edildiğinde radyoaktif hale geldiğini gösterdi. Bu durumda titanyum pozitronlar ve şiddetli gama ışınları yayımlar. Kızarmış bir metal olduğunda oksijenle ve sıcaklığı 550 °C'ye (1,022 °F) ulaştığında klor ile bileşik oluşturur. Titanyum ayrıca diğer halojenlerle de reaksiyona girer ve hidrojen ⓘ
Oluşum
Titanyum, yerkabuğunda en bol bulunan dokuzuncu element (kütlece %0,63) ve en bol bulunan yedinci metaldir. Çoğu magmatik kayaçta, bunlardan elde edilen tortularda, canlılarda ve doğal su kütlelerinde oksit olarak bulunur. Amerika Birleşik Devletleri Jeoloji Araştırmaları tarafından analiz edilen 801 magmatik kayaç türünden 784'ü titanyum içermektedir. Topraktaki oranı yaklaşık %0,5 ila 1,5'tir. ⓘ
Yaygın titanyum içeren mineraller anataz, brookit, ilmenit, perovskit, rutil ve titanittir (sphene). Akaogiite, titanyum dioksitten oluşan son derece nadir bir mineraldir. Bu minerallerden sadece rutil ve ilmenit ekonomik öneme sahiptir, ancak bunların bile yüksek konsantrasyonlarda bulunması zordur. Bu minerallerden 2011 yılında sırasıyla yaklaşık 6,0 ve 0,7 milyon ton çıkarılmıştır. Batı Avustralya, Kanada, Çin, Hindistan, Mozambik, Yeni Zelanda, Norveç, Sierra Leone, Güney Afrika ve Ukrayna'da önemli titanyum içeren ilmenit yatakları bulunmaktadır. 2020 yılında çoğunluğu Çin (110.000 t), Japonya (50.000 t), Rusya (33.000 t) ve Kazakistan'da (15.000 t) olmak üzere yaklaşık 210.000 ton titanyum metal sünger üretilmiştir. Toplam anataz, ilmenit ve rutil rezervlerinin 2 milyar tonu aştığı tahmin edilmektedir. ⓘ
| Ülke | bin tonlar |
Toplamın %'si ⓘ |
|---|---|---|
| Çin | 3,830 | 33.1 |
| Avustralya | 1,513 | 13.1 |
| Mozambik | 1,070 | 9.3 |
| Kanada | 1,030 | 8.9 |
| Güney Afrika | 743 | 6.4 |
| Kenya | 562 | 4.9 |
| Hindistan | 510 | 4.4 |
| Senegal | 502 | 4.3 |
| Ukrayna | 492 | 4.3 |
| Dünya | 11,563 | 100 |
Titanyum konsantrasyonu okyanusta yaklaşık 4 pikomolardır. Sulu çözeltideki titanyum türlerinin kimliği, düşük çözünürlüğü ve hassas spektroskopik yöntemlerin eksikliği nedeniyle bilinmemektedir, ancak sadece 4+ oksidasyon durumu havada stabildir. 100 °C'de, sudaki titanyum konsantrasyonunun pH 7'de 10-7 M'dan az olduğu tahmin edilmektedir. Nadir organizmaların yüksek konsantrasyonlarda titanyum biriktirdiği bilinmesine rağmen, biyolojik bir rolü olduğuna dair hiçbir kanıt yoktur. ⓘ
Titanyum meteoritlerde bulunur ve Güneş'te ve yüzey sıcaklığı 3.200 °C (5.790 °F) olan M tipi yıldızlarda (en soğuk tür) tespit edilmiştir. Apollo 17 görevi sırasında Ay'dan getirilen kayalar %12,1 TiO2'den oluşmaktadır. Doğal titanyum (saf metalik) çok nadirdir. ⓘ
| Üretici | Bin ton | Toplamdaki % |
|---|---|---|
| Avustralya | 1291.0 | 30.6 |
| Güney Afrika | 850.0 | 20.1 |
| Kanada | 767.0 | 18.2 |
| Norveç | 382.9 | 9.1 |
| Ukrayna | 357.0 | 8.5 |
| Diğer ülkeler | 573.1 | 13.6 |
| Toplam | 4221.0 | 100.1 |
Yuvarlamalar yüzünden toplam % 100 değildir. ⓘ
İzotoplar
Doğal olarak oluşan titanyum beş kararlı izotoptan oluşur: 46Ti, 47Ti, 48Ti, 49Ti ve 50Ti, 48Ti en bol olanıdır (%73,8 doğal bolluk). En az 21 radyoizotop karakterize edilmiştir; bunlardan en kararlı olanları 63 yıllık yarı ömre sahip 44Ti; 184,8 dakikalık 45Ti; 5,76 dakikalık 51Ti ve 1,7 dakikalık 52Ti'dir. Diğer tüm radyoaktif izotopların yarı ömürleri 33 saniyeden azdır ve çoğunluğu yarım saniyeden azdır. ⓘ
Titanyum izotoplarının atom ağırlığı 39.002 u (39Ti) ile 63.999 u (64Ti) arasında değişir. 46Ti'den daha hafif izotoplar için birincil bozunma modu pozitron emisyonudur (elektron yakalamaya maruz kalan 44Ti hariç) ve skandiyum izotoplarına yol açar ve 50Ti'den daha ağır izotoplar için birincil mod beta emisyonudur ve vanadyum izotoplarına yol açar. ⓘ
Titanyum, döteronlarla bombardıman edildiğinde radyoaktif hale gelir ve esas olarak pozitronlar ve sert gama ışınları yayar. ⓘ
Bileşikler

4 oksidasyon durumu titanyum kimyasına hakimdir, ancak +3 oksidasyon durumundaki bileşikler de çok sayıdadır. Genellikle titanyum, komplekslerinde oktahedral bir koordinasyon geometrisi benimser, ancak tetrahedral TiCl4 dikkate değer bir istisnadır. Yüksek oksidasyon durumu nedeniyle, titanyum (IV) bileşikleri yüksek derecede kovalent bağ sergiler. ⓘ
Oksitler, sülfürler ve alkoksitler
En önemli oksit, üç önemli polimorfta bulunan TiO2'dir; anataz, brookit ve rutil. Her üçü de beyaz diamanyetik katılardır, ancak mineral örnekleri koyu renkli görünebilir (bkz. rutil). Ti'nin diğer Ti merkezlerine bağlanan altı oksit ligandıyla çevrelendiği polimerik yapıları benimserler. ⓘ
Titanatlar terimi genellikle baryum titanat (BaTiO3) ile temsil edildiği gibi titanyum (IV) bileşiklerini ifade eder. Perovskit bir yapıya sahip olan bu malzeme piezoelektrik özellikler sergiler ve ses ile elektriğin birbirine dönüştürülmesinde bir dönüştürücü olarak kullanılır. İlmenit (FeTiO3) gibi birçok mineral titanattır. Yıldız safirleri ve yakutlar asterizmlerini (yıldız oluşturan parlaklık) titanyum dioksit safsızlıklarının varlığından alırlar. ⓘ
Titanyumun çeşitli indirgenmiş oksitleri (altoksitler) bilinmektedir, bunların başlıcaları atmosferik plazma püskürtme ile elde edilen indirgenmiş titanyum dioksit stokiyometrileridir. Ti(IV)-Ti(III) türü olarak tanımlanan Ti3O5, TiO2'nin yüksek sıcaklıklarda hidrojenle indirgenmesiyle üretilen mor bir yarı iletkendir ve yüzeylerin titanyum dioksit ile buharla kaplanması gerektiğinde endüstriyel olarak kullanılır: saf TiO olarak buharlaşırken, TiO2 bir oksit karışımı olarak buharlaşır ve değişken kırılma indisine sahip kaplamalar biriktirir. Ayrıca korundum yapısına sahip Ti2O3 ve genellikle stokiyometrik olmamasına rağmen kaya tuzu yapısına sahip TiO da bilinmektedir. ⓘ
TiCl4'ün alkollerle muamele edilmesiyle hazırlanan titanyum (IV) alkoksitler, su ile reaksiyona girdiğinde dioksite dönüşen renksiz bileşiklerdir. Sol-jel işlemi yoluyla katı TiO2 biriktirmek için endüstriyel olarak kullanışlıdırlar. Titanyum izopropoksit, Sharpless epoksidasyonu yoluyla kiral organik bileşiklerin sentezinde kullanılır. ⓘ
Titanyum çeşitli sülfürler oluşturur, ancak yalnızca TiS2 önemli ölçüde ilgi çekmiştir. Katmanlı bir yapıya sahiptir ve lityum pillerin geliştirilmesinde katot olarak kullanılmıştır. Ti(IV) "sert bir katyon" olduğundan, titanyum sülfürleri kararsızdır ve hidrojen sülfür salınımı ile okside hidrolize olma eğilimindedir. ⓘ
Nitrürler ve karbürler
Titanyum nitrür (TiN) aşırı sertlik, termal/elektriksel iletkenlik ve yüksek erime noktası sergileyen refrakter bir katıdır. TiN, safir ve karborunduma eşdeğer bir sertliğe sahiptir (Mohs ölçeğinde 9.0) ve genellikle matkap uçları gibi kesme aletlerini kaplamak için kullanılır. Aynı zamanda altın renkli dekoratif kaplama olarak ve yarı iletken imalatında bariyer tabakası olarak kullanılır. Aynı zamanda çok sert olan titanyum karbür (TiC), kesici aletlerde ve kaplamalarda bulunur. ⓘ
Halojenürler

Titanyum tetraklorür (titanyum(IV) klorür, TiCl4) renksiz uçucu bir sıvıdır (ticari numuneler sarımsıdır) ve havada beyaz bulutların muhteşem emisyonuyla hidrolize olur. TiCl4, Kroll prosesi aracılığıyla titanyum cevherlerinin titanyum metaline dönüştürülmesinde kullanılır. Titanyum tetraklorür, örneğin beyaz boyada kullanılmak üzere titanyum dioksit yapımında da kullanılır. Organik kimyada Lewis asidi olarak, örneğin Mukaiyama aldol kondensasyonunda yaygın olarak kullanılır. Van Arkel-de Boer prosesinde, yüksek saflıkta titanyum metali üretiminde titanyum tetraiyodür (TiI4) üretilir. ⓘ
Titanyum(III) ve titanyum(II) ayrıca kararlı klorürler oluşturur. Kayda değer bir örnek, poliolefinlerin üretiminde katalizör (bkz. Ziegler-Natta katalizörü) ve organik kimyada indirgeyici ajan olarak kullanılan titanyum (III) klorürdür (TiCl3). ⓘ
Organometalik kompleksler
Titanyum bileşiklerinin polimerizasyon katalizörü olarak önemli rolü nedeniyle, Ti-C bağlarına sahip bileşikler yoğun bir şekilde incelenmiştir. En yaygın organotitanyum kompleksi titanosen diklorürdür ((C5H5)2TiCl2). İlgili bileşikler Tebbe reaktifi ve Petasis reaktifini içerir. Titanyum karbonil kompleksleri oluşturur, örneğin (C5H5)2Ti(CO)2. ⓘ
Antikanser terapi çalışmaları
Platin bazlı kemoterapinin başarısının ardından, titanyum(IV) kompleksleri kanser tedavisi için test edilen ilk platin olmayan bileşikler arasında yer almıştır. Titanyum bileşiklerinin avantajı, in vivo olarak yüksek etkinlik ve düşük toksisiteye sahip olmalarında yatmaktadır. Biyolojik ortamlarda hidroliz, güvenli ve inert titanyum dioksite yol açar. Bu avantajlara rağmen ilk aday bileşikler, yetersiz etkinlik-toksisite oranları ve formülasyon komplikasyonları nedeniyle klinik deneylerde başarısız olmuştur. Daha fazla geliştirme, potansiyel olarak etkili, seçici ve stabil titanyum bazlı ilaçların yaratılmasıyla sonuçlandı. ⓘ
Tarih

Titanyum 1791 yılında din adamı ve amatör jeolog William Gregor tarafından Cornwall, Büyük Britanya'da bir mineral olarak keşfedilmiştir. Gregor, bir dere kenarında siyah kum bulduğunda ve kumun bir mıknatıs tarafından çekildiğini fark ettiğinde ilmenitte yeni bir elementin varlığını fark etti. Kumu analiz ederek iki metal oksidin varlığını tespit etti: demir oksit (mıknatısın çekimini açıklıyor) ve tanımlayamadığı beyaz bir metalik oksidin %45,25'i. Tanımlanamayan oksidin bilinen hiçbir elementle eşleşmeyen bir metal içerdiğini fark eden Gregor, bulgularını Cornwall Kraliyet Jeoloji Derneği'ne ve Alman bilim dergisi Crell's Annalen'e bildirdi. ⓘ
Aynı tarihlerde Franz-Joseph Müller von Reichenstein da benzer bir madde üretmiş ancak tanımlayamamıştır. Oksit, 1795 yılında Prusyalı kimyager Martin Heinrich Klaproth tarafından Macaristan'da bir köy olan Boinik'ten (şimdiki Slovakya'da Bojničky) rutil içinde bağımsız olarak yeniden keşfedildi (Bajmócska'nın Almanca adı). Klaproth bunun yeni bir element içerdiğini keşfetti ve Yunan mitolojisindeki Titanların adını verdi. Gregor'un daha önceki keşfini duyduktan sonra, bir manakanit örneği elde etti ve titanyum içerdiğini doğruladı. ⓘ
Titanyumu çeşitli cevherlerinden çıkarmak için şu anda bilinen işlemler zahmetli ve maliyetlidir; cevheri karbonla ısıtarak (demir eritmede olduğu gibi) indirgemek mümkün değildir çünkü titanyum karbonla birleşerek titanyum karbür üretir. Saf metalik titanyum (%99,9) ilk olarak 1910 yılında Matthew A. Hunter tarafından Rensselaer Politeknik Enstitüsü'nde, TiCl4'ün sodyum ile 700-800 °C'de yüksek basınç altında ısıtılmasıyla Hunter prosesi olarak bilinen kesikli bir işlemle hazırlanmıştır. Titanyum metali, William Justin Kroll'un titanyum tetraklorürü (TiCl4) kalsiyum ile indirgeyerek ürettiği 1932 yılına kadar laboratuvar dışında kullanılmadı. Sekiz yıl sonra bu prosesi magnezyum ve sodyum ile rafine ederek Kroll prosesi olarak bilinen prosesi geliştirdi. Araştırmalar FFC Cambridge süreci gibi daha ucuz ve daha verimli yollar aramaya devam etse de, Kroll süreci ticari üretim için hala ağırlıklı olarak kullanılmaktadır. ⓘ

Anton Eduard van Arkel ve Jan Hendrik de Boer 1925 yılında iyodür prosesini keşfettiğinde, iyot ile reaksiyona girerek ve oluşan buharları sıcak bir filament üzerinde saf metale ayrıştırarak çok yüksek saflıkta titanyum küçük miktarlarda üretildi. ⓘ
1950'lerde ve 1960'larda Sovyetler Birliği, Soğuk Savaş ile ilgili programların bir parçası olarak askeri ve denizaltı uygulamalarında (Alfa sınıfı ve Mike sınıfı) titanyum kullanımına öncülük etti. 1950'lerin başından itibaren titanyum, F-100 Super Sabre ve Lockheed A-12 ve SR-71 gibi uçaklardan başlayarak askeri havacılıkta, özellikle de yüksek performanslı jetlerde yaygın olarak kullanılmaya başlandı. ⓘ
Soğuk Savaş dönemi boyunca titanyum, ABD hükümeti tarafından stratejik bir malzeme olarak kabul edildi ve 2000'li yıllarda stok dağılana kadar Savunma Ulusal Stok Merkezi tarafından büyük bir titanyum sünger stoku (saf metalin gözenekli bir formu) tutuldu. 2021 itibariyle, önde gelen dört titanyum sünger üreticisi Çin (%52), Japonya (%24), Rusya (%16) ve Kazakistan (%7) idi. ⓘ

Üretim


Titanyum metalinin işlenmesi dört ana adımda gerçekleşir: titanyum cevherinin gözenekli bir form olan "süngere" indirgenmesi; bir külçe oluşturmak için süngerin veya sünger artı bir ana alaşımın eritilmesi; bir külçenin kütük, çubuk, levha, tabaka, şerit ve tüp gibi genel değirmen ürünlerine dönüştürüldüğü birincil imalat; ve değirmen ürünlerinden bitmiş şekillerin ikincil imalatı. ⓘ
Titanyum dioksitin indirgenmesiyle kolayca üretilemediği için titanyum metali, Kroll işleminde TiCl4'ün magnezyum metaliyle indirgenmesiyle elde edilir. Kroll sürecindeki bu toplu üretimin karmaşıklığı, Kroll sürecinin Hunter sürecinden daha ucuz olmasına rağmen titanyumun nispeten yüksek piyasa değerini açıklamaktadır. Kroll prosesinin gerektirdiği TiCl4'ü üretmek için dioksit, klor varlığında karbotermik indirgemeye tabi tutulur. Bu proseste, klor gazı karbon varlığında kızgın bir rutil veya ilmenit karışımı üzerinden geçirilir. Fraksiyonel damıtma ile kapsamlı saflaştırmadan sonra TiCl4, argon atmosferinde 800 °C (1.470 °F) erimiş magnezyum ile indirgenir. Titanyum metali, titanyum tetraiodidin termal ayrışmasını içeren van Arkel-de Boer işlemi ile daha da saflaştırılabilir.
- Ayrıştırılamadı (sözdizim hatası): {\displaystyle \ce{TiCl4 + 2Mg ->[1100^oC] Ti + 2MgCl2 <span title="Kaynak: İngilizce Vikipedi, Bölüm "Production"" class="plainlinks">[https://en.wikipedia.org/wiki/Titanium#Production <span style="color:#dddddd">ⓘ</span>]</span>}}
Yaygın titanyum alaşımları indirgeme yoluyla yapılır. Örneğin, kuprotitanyum (bakır eklenmiş rutil indirgenir), ferrokarbon titanyum (elektrikli fırında kok ile indirgenmiş ilmenit) ve manganotitanyum (manganez veya manganez oksitler ile rutil) indirgenir. ⓘ
Yaklaşık elli çeşit titanyum alaşımı tasarlanmış ve şu anda kullanılmaktadır, ancak sadece birkaç düzine ticari olarak hazır bulunmaktadır. ASTM International, 31 çeşit titanyum metali ve alaşımını tanımaktadır; bunlardan bir ila dört arası ticari olarak saftır (alaşımsız). Bu dört sınıf, oksijen içeriğinin bir fonksiyonu olarak gerilme mukavemetine göre değişir; 1. sınıf en sünek (%0,18 oksijen içeriğiyle en düşük gerilme mukavemeti) ve 4. sınıf en az sünektir (%0,40 oksijen içeriğiyle en yüksek gerilme mukavemeti). Geri kalan kaliteler, her biri süneklik, mukavemet, sertlik, elektrik direnci, sürünme direnci, spesifik korozyon direnci ve bunların kombinasyonlarının belirli özellikleri için tasarlanmış alaşımlardır. ⓘ
ASTM spesifikasyonlarına ek olarak, titanyum alaşımları havacılık ve askeri spesifikasyonlar (SAE-AMS, MIL-T), ISO standartları ve ülkeye özgü spesifikasyonların yanı sıra havacılık, askeri, tıbbi ve endüstriyel uygulamalar için özel son kullanıcı spesifikasyonlarını karşılamak üzere de üretilmektedir. ⓘ
Titanyum tozu, Armstrong süreci olarak bilinen ve seri üretim Hunter sürecine benzeyen bir akış üretim süreci kullanılarak üretilir. Erimiş sodyum akışına bir titanyum tetraklorür gazı akışı eklenir; ürünler (sodyum klorür tuzu ve titanyum parçacıkları) ekstra sodyumdan süzülür. Titanyum daha sonra suyla yıkanarak tuzdan ayrılır. Hem sodyum hem de klor, daha fazla titanyum tetraklorür üretmek ve işlemek için geri dönüştürülür. ⓘ
Fabrikasyon
Titanyumun tüm kaynağı, atmosferik gazlarla (oksijen, nitrojen ve hidrojen) kirlenmesini önlemek için argon veya helyumdan oluşan inert bir atmosferde yapılmalıdır. Kontaminasyon, montaj kaynaklarının bütünlüğünü azaltan ve bağlantı hatasına yol açan gevrekleşme gibi çeşitli koşullara neden olur. ⓘ
Titanyumun doğrudan lehimlenmesi çok zordur ve bu nedenle lehimlemeden önce titanyum üzerine çelik gibi lehimlenebilir bir metal veya alaşım kaplanır. Titanyum metali paslanmaz çelikle aynı ekipman ve aynı işlemlerle işlenebilir. ⓘ
Şekillendirme ve dövme
Ticari olarak saf yassı ürün (levha, plaka) kolayca şekillendirilebilir, ancak işleme metalin geri yaylanma eğilimini dikkate almalıdır. Bu durum özellikle bazı yüksek mukavemetli alaşımlar için geçerlidir. Dövmede kullanılan yüksek sıcaklıklarda havadaki oksijene maruz kalmak, yorulma özelliklerini kötüleştiren "alfa kılıfı" adı verilen kırılgan, oksijen bakımından zengin metalik bir yüzey tabakasının oluşmasına neden olur, bu nedenle frezeleme, aşındırma veya elektrokimyasal işlemle çıkarılması gerekir. ⓘ
Uygulamalar

Titanyum çelikte alaşım elementi (ferro-titanyum) olarak tane boyutunu küçültmek ve oksijen giderici olarak ve paslanmaz çelikte karbon içeriğini azaltmak için kullanılır. Titanyum genellikle alüminyum (tane boyutunu iyileştirmek için), vanadyum, bakır (sertleştirmek için), demir, manganez, molibden ve diğer metallerle alaşımlandırılır. Titanyum değirmen ürünleri (levha, plaka, çubuk, tel, dövme, döküm) endüstriyel, havacılık, eğlence ve gelişmekte olan pazarlarda uygulama alanı bulmaktadır. Toz titanyum piroteknikte parlak yanan parçacıkların kaynağı olarak kullanılır. ⓘ
Pigmentler, katkı maddeleri ve kaplamalar

Tüm titanyum cevherinin yaklaşık %95'i rafine edilerek titanyum dioksite (TiO
2), boyalarda, kağıtta, diş macununda ve plastiklerde kullanılan yoğun beyaz kalıcı bir pigmenttir. Ayrıca çimentoda, değerli taşlarda, kağıtta optik opaklaştırıcı olarak ve grafit kompozit oltalarda ve golf sopalarında güçlendirici bir madde olarak kullanılır. ⓘ
TiO
2 pigmenti kimyasal olarak inerttir, güneş ışığında solmaya karşı dirençlidir ve çok opaktır: ev plastiklerinin çoğunu oluşturan kahverengi veya gri kimyasallara saf ve parlak beyaz bir renk verir. Bu bileşik doğada anataz, brookit ve rutil minerallerinde bulunur. Titanyum dioksit ile yapılan boyalar şiddetli sıcaklıklarda ve deniz ortamlarında iyi sonuç verir. Saf titanyum dioksit çok yüksek bir kırılma indisine ve elmastan daha yüksek bir optik dağılıma sahiptir. Titanyum dioksit çok önemli bir pigment olmasının yanı sıra güneş kremlerinde de kullanılır. ⓘ
Havacılık ve denizcilik
Titanyum alaşımları yüksek gerilme mukavemetinin yoğunluğa oranı, yüksek korozyon direnci, yorulma direnci, yüksek çatlama direnci ve sürünme olmadan orta derecede yüksek sıcaklıklara dayanma kabiliyetine sahip olduğundan, uçaklarda, zırh kaplamalarında, donanma gemilerinde, uzay araçlarında ve füzelerde kullanılır. Bu uygulamalar için titanyum alüminyum, zirkonyum, nikel, vanadyum ve diğer elementlerle alaşım haline getirilerek kritik yapısal parçalar, yangın duvarları, iniş takımları, egzoz kanalları (helikopterler) ve hidrolik sistemler dahil olmak üzere çeşitli bileşenler üretilmektedir. Aslında, üretilen tüm titanyum metalinin yaklaşık üçte ikisi uçak motorlarında ve şasilerinde kullanılmaktadır. Titanyum 6AL-4V alaşımı, uçak uygulamalarında kullanılan tüm alaşımların neredeyse %50'sini oluşturmaktadır. ⓘ
Lockheed A-12 ve onun geliştirilmiş hali olan SR-71 "Blackbird", titanyumun kullanıldığı ilk uçak gövdelerinden ikisiydi ve modern askeri ve ticari uçaklarda çok daha geniş kullanımın önünü açtı. Birçok uçağın üretiminde büyük miktarda titanyum değirmen ürünleri kullanılmaktadır, örneğin (aşağıdaki değerler kullanılan ham değirmen ürünlerinin miktarıdır... bunun sadece bir kısmı bitmiş uçakta son bulur): Boeing 787'de 116, Airbus A380'de 77, Boeing 777'de 59, Boeing 747'de 45, Boeing 737'de 18, Airbus A340'ta 32, Airbus A330'da 18 ve Airbus A320'de 12 metrik ton kullanılmaktadır. Aero motor uygulamalarında titanyum rotorlar, kompresör kanatları, hidrolik sistem bileşenleri ve motor kaportaları için kullanılır. Jet motorlarında erken bir kullanım 1950'lerde Orenda Iroquois içindi. ⓘ
Titanyum deniz suyunun korozyonuna karşı dirençli olduğundan, tuzdan arındırma tesislerinde pervane şaftları, donanım ve ısı eşanjörleri; tuzlu su akvaryumları için ısıtıcı-soğutucular, olta ve lider ve dalgıç bıçakları yapımında kullanılır. Titanyum, bilim ve ordu için okyanusta konuşlandırılmış gözetleme ve izleme cihazlarının muhafazalarında ve bileşenlerinde kullanılır. Eski Sovyetler Birliği, titanyumu devasa vakum tüplerinde döverek titanyum alaşımlarından gövdeli denizaltılar yapmak için teknikler geliştirmiştir. ⓘ
Titanyum, Juno uzay aracının kasasının duvarlarında yerleşik elektronikleri korumak için kullanılmaktadır. ⓘ
Endüstriyel

Kaynaklı titanyum boru ve proses ekipmanları (ısı eşanjörleri, tanklar, proses kapları, vanalar) kimya ve petrokimya endüstrilerinde öncelikle korozyon direnci için kullanılır. Belirli alaşımlar, petrol ve gaz kuyu içi uygulamalarında ve nikel hidrometalurjisinde yüksek mukavemetleri (örneğin: titanyum beta C alaşımı), korozyon direnci veya her ikisi için kullanılır. Kağıt hamuru ve kağıt endüstrisi, sodyum hipoklorit veya ıslak klor gazı (çamaşırhanede) gibi aşındırıcı ortamlara maruz kalan proses ekipmanlarında titanyum kullanır. Diğer uygulamalar arasında ultrasonik kaynak, dalga lehimleme ve püskürtme hedefleri bulunur. ⓘ
Renksiz bir sıvı olan titanyum tetraklorür (TiCl4), TiO2 yapım sürecinde bir ara madde olarak önemlidir ve Ziegler-Natta katalizörünü üretmek için de kullanılır. Titanyum tetraklorür ayrıca camı iridize etmek için kullanılır ve nemli havada güçlü bir şekilde duman çıkardığı için duman perdesi yapımında kullanılır. ⓘ
Tüketici ve mimari
Titanyum metali otomotiv uygulamalarında, özellikle de düşük ağırlık ve yüksek mukavemet ve sertliğin kritik olduğu otomobil ve motosiklet yarışlarında kullanılır. Metal genel tüketici pazarı için genellikle çok pahalıdır, ancak bazı son model Corvette'ler titanyum egzozlarla üretilmiştir ve Corvette Z06'nın LT4 süperşarjlı motoru, daha fazla güç ve ısıya karşı direnç için hafif, katı titanyum emme valfleri kullanır. ⓘ
Titanyum birçok spor malzemesinde kullanılmaktadır: tenis raketleri, golf sopaları, lakros sopası şaftları; kriket, hokey, lakros ve futbol kask ızgaraları ve bisiklet çerçeveleri ve bileşenleri. Bisiklet üretimi için ana akım bir malzeme olmamasına rağmen, titanyum bisikletler yarış takımları ve macera bisikletçileri tarafından kullanılmıştır. ⓘ
Titanyum alaşımları, oldukça pahalı ancak son derece dayanıklı, uzun ömürlü, hafif ve cilt alerjisine neden olmayan gözlük çerçevelerinde kullanılır. Birçok sırt çantalı gezgin, pişirme kapları, yemek kapları, fenerler ve çadır kazıkları da dahil olmak üzere titanyum ekipman kullanmaktadır. Geleneksel çelik veya alüminyum alternatiflerinden biraz daha pahalı olsa da, titanyum ürünler mukavemetten ödün vermeden önemli ölçüde daha hafif olabilir. Titanyum nallar, daha hafif ve daha dayanıklı oldukları için nalbantlar tarafından çeliğe tercih edilmektedir. ⓘ

Titanyum zaman zaman mimaride de kullanılmıştır. Uzayda seyahat eden ilk insan olan Yuri Gagarin'in 42,5 m (139 ft) uzunluğundaki anıtı (55°42′29.7″N 37°34′57.2″E / 55.708250°N 37.582556°E) ve Moskova'daki Kozmonot Müzesi'nin tepesindeki 110 m (360 ft) uzunluğundaki Uzay Fatihleri Anıtı, metalin çekici rengi ve roketçilikle olan ilişkisi nedeniyle titanyumdan yapılmıştır. Guggenheim Bilbao Müzesi ve Cerritos Millennium Kütüphanesi sırasıyla Avrupa ve Kuzey Amerika'da titanyum panellerle kaplanan ilk binalardır. Titanyum kaplama Denver, Colorado'daki Frederic C. Hamilton Binası'nda kullanılmıştır. ⓘ
Titanyumun diğer metallere (çelik, paslanmaz çelik ve alüminyum) göre üstün mukavemeti ve hafifliği ve metal işleme tekniklerindeki son gelişmeler nedeniyle, ateşli silahların üretiminde kullanımı daha yaygın hale gelmiştir. Başlıca kullanım alanları arasında tabanca gövdeleri ve revolver silindirleri bulunmaktadır. Aynı nedenlerle dizüstü bilgisayarların gövdesinde de kullanılmaktadır (örneğin Apple'ın PowerBook serisinde). ⓘ
Kürekler, bıçak sapları ve el fenerleri gibi bazı üst sınıf hafif ve korozyona dayanıklı aletler titanyum veya titanyum alaşımlarından yapılmıştır. ⓘ
Mücevher

Dayanıklılığı nedeniyle titanyum, tasarım takılar (özellikle titanyum yüzükler) için daha popüler hale gelmiştir. İnert olması, alerjisi olanlar veya yüzme havuzları gibi ortamlarda takı takacak olanlar için iyi bir seçim olmasını sağlar. Titanyum ayrıca 24 ayar altın olarak pazarlanabilen bir alaşım üretmek için altınla alaşımlandırılır çünkü alaşımlı Ti'nin %1'i daha az bir işaret gerektirmek için yetersizdir. Elde edilen alaşım kabaca 14 ayar altının sertliğindedir ve saf 24 ayar altından daha dayanıklıdır. ⓘ
Titanyumun dayanıklılığı, hafifliği, göçme ve korozyon direnci onu saat kasaları için kullanışlı hale getirir. Bazı sanatçılar heykeller, dekoratif objeler ve mobilyalar üretmek için titanyum ile çalışırlar. ⓘ
Titanyum, yüzey oksit tabakasının kalınlığını değiştirmek için anodize edilebilir, bu da optik girişim saçaklarına ve çeşitli parlak renklere neden olur. Bu renklendirme ve kimyasal inertlik sayesinde titanyum vücut piercingi için popüler bir metaldir. ⓘ
Titanyum, tedavülde olmayan özel madeni para ve madalyalarda küçük bir kullanıma sahiptir. Cebelitarık 1999 yılında milenyum kutlamaları için dünyanın ilk titanyum madeni parasını piyasaya sürmüştür. Bir Avustralya rugby ligi takımı olan Gold Coast Titans, yılın oyuncusuna saf titanyumdan bir madalya vermektedir. ⓘ
Tıbbi
Titanyum biyouyumlu (toksik olmayan ve vücut tarafından reddedilmeyen) olduğundan, kalça topları ve soketleri (eklem replasmanı) ve 20 yıla kadar yerinde kalabilen diş implantları gibi cerrahi aletler ve implantlar da dahil olmak üzere birçok tıbbi kullanıma sahiptir. Titanyum genellikle yaklaşık %4 alüminyum veya %6 Al ve %4 vanadyum ile alaşımlandırılır. ⓘ

Titanyum, 30 yıldan fazla dayanabilen diş implantlarında kullanılmasını sağlayan osseointegrasyon yeteneğine sahiptir. Bu özellik ortopedik implant uygulamaları için de yararlıdır. Bunlar, titanyumun daha düşük elastikiyet modülünden (Young modülü) yararlanarak, bu tür cihazların onarması amaçlanan kemiğe daha yakın bir şekilde eşleşir. Sonuç olarak, iskelet yükleri kemik ve implant arasında daha eşit bir şekilde paylaşılır, bu da ortopedik implantların sınırlarında meydana gelen stres kalkanı ve periprostetik kemik kırıkları nedeniyle daha düşük kemik bozulması insidansına yol açar. Bununla birlikte, titanyum alaşımlarının sertliği hala kemiğin iki katından fazladır, bu nedenle bitişik kemik büyük ölçüde azaltılmış bir yük taşır ve bozulabilir. ⓘ
Titanyum ferromanyetik olmadığından, titanyum implantlı hastalar manyetik rezonans görüntüleme ile güvenle incelenebilir (uzun süreli implantlar için uygundur). Titanyumun vücuda implantasyon için hazırlanması, yüzey atomlarını ortadan kaldıran ve anında oksitlenen taze titanyumu açığa çıkaran yüksek sıcaklıkta bir plazma arkına tabi tutulmasını içerir. ⓘ
Katmanlı üretim tekniklerindeki modern gelişmeler, ortopedik implant uygulamalarında titanyum kullanım potansiyelini artırmıştır. Titanyum alaşımları kullanılarak karmaşık implant iskelesi tasarımları 3D olarak basılabilmekte, bu da hastaya özel uygulamaların ve implant osseointegrasyonunun artmasına olanak sağlamaktadır. ⓘ
Titanyum, görüntü güdümlü cerrahide kullanılan cerrahi aletlerin yanı sıra tekerlekli sandalyeler, koltuk değnekleri ve yüksek mukavemet ve düşük ağırlığın arzu edildiği diğer ürünler için kullanılır. ⓘ
Titanyum dioksit nanopartikülleri elektronikte ve ilaç ve kozmetiklerin dağıtımında yaygın olarak kullanılmaktadır. ⓘ
Nükleer atık depolama
Korozyon direnci nedeniyle, titanyumdan yapılmış konteynerler nükleer atıkların uzun süreli depolanması için incelenmiştir. Malzeme kusurlarını en aza indiren üretim koşullarıyla 100.000 yıldan daha uzun ömürlü konteynerlerin mümkün olduğu düşünülmektedir. Uzun ömürlülüklerini artırmak için diğer tipteki konteynerlerin üzerine titanyum bir "damlama kalkanı" da yerleştirilebilir. ⓘ
Önlemler
Titanyum yüksek dozlarda bile toksik değildir ve insan vücudunda doğal bir rol oynamaz. İnsanlar tarafından her gün tahmini olarak 0,8 miligram titanyum yutulur, ancak çoğu dokularda emilmeden geçer. Bununla birlikte, bazen silika içeren dokularda biyolojik olarak birikir. Bir çalışma titanyum ve sarı tırnak sendromu arasında olası bir bağlantı olduğunu göstermektedir. ⓘ
Toz halinde veya metal talaşı şeklinde titanyum metali önemli bir yangın tehlikesi ve havada ısıtıldığında patlama tehlikesi oluşturur. Su ve karbondioksit bir titanyum yangınını söndürmek için etkisizdir; bunun yerine D Sınıfı kuru toz maddeler kullanılmalıdır. ⓘ
Klor üretiminde veya kullanımında kullanıldığında, titanyum kuru klor gazına maruz bırakılmamalıdır, çünkü titanyum-klor yangınına neden olabilir. ⓘ
Titanyum, taze, oksitlenmemiş bir yüzey sıvı oksijen ile temas ettiğinde alev alabilir. ⓘ
Bitkilerdeki işlevi

Bitkilerdeki bilinmeyen bir mekanizma titanyumu karbonhidrat üretimini uyarmak ve büyümeyi teşvik etmek için kullanıyor olabilir. Bu, çoğu bitkinin neden milyonda 1 parça (ppm) titanyum içerdiğini, gıda bitkilerinin yaklaşık 2 ppm ve at kuyruğu ve ısırgan otunun 80 ppm'ye kadar titanyum içerdiğini açıklayabilir. ⓘ
![{\displaystyle {\ce {2FeTiO3 + 7Cl2 + 6C ->[900^oC] 2FeCl3 + 2TiCl4 + 6CO}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1eeb2d68819d30ab4f11311db1e92a04acc56bc6)