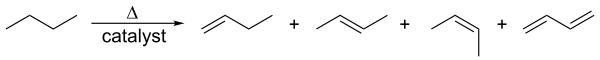Alken
Organik kimyada alken, karbon-karbon çift bağı içeren bir hidrokarbondur. ⓘ
Alken genellikle olefin, yani bir veya daha fazla çift bağ içeren herhangi bir hidrokarbon ile eşanlamlı olarak kullanılır. İki genel monoalken türü ayırt edilir: terminal ve iç. α-olefinler olarak da adlandırılan terminal alkenler daha kullanışlıdır. ⓘ
Bununla birlikte, Uluslararası Saf ve Uygulamalı Kimya Birliği (IUPAC) "alken" adının yalnızca bir çift bağ içeren asiklik hidrokarbonlar için kullanılmasını önermektedir; iki veya daha fazla çift bağ içeren asiklik hidrokarbonlar için alkadien, alkatrien, vb. veya polien; siklik olanlar için sikloalken, sikloalkadien, vb. ve genel sınıf için "olefin" - bir veya daha fazla çift bağ içeren siklik veya asiklik. ⓘ
Sadece bir çift bağı olan ve başka hiçbir fonksiyonel grubu olmayan asiklik alkenler (mono-enler olarak da bilinir), n 2 veya daha fazla olmak üzere (karşılık gelen alkandan iki hidrojen daha az olan) CnH2n genel formülüne sahip homolog bir hidrokarbon serisi oluşturur. N dört veya daha fazla olduğunda, çift bağın konumu ve konformasyonu ile ayırt edilen izomerler mümkündür. ⓘ
Alkenler genellikle renksiz polar olmayan bileşiklerdir, alkanlara biraz benzerler ancak daha reaktiftirler. Serinin ilk birkaç üyesi oda sıcaklığında gaz veya sıvıdır. En basit alken olan etilen (C2H4) (veya IUPAC terminolojisinde "eten") endüstriyel olarak en büyük ölçekte üretilen organik bileşiktir. ⓘ
Aromatik bileşikler genellikle siklik alkenler olarak çizilir, ancak yapıları ve özellikleri alkenler veya olefinler olarak sınıflandırılmayacak kadar farklıdır. Üst üste binen iki çift bağa (C=C=C) sahip hidrokarbonlar allen olarak adlandırılır - bu tür en basit bileşiğin kendisi allen olarak adlandırılır - ve üç veya daha fazla üst üste binen bağa (C=C=C=C, C=C=C=C=C, vb.) sahip olanlar kümülen olarak adlandırılır. Bazı yazarlar allenleri ve kümülenleri "alken" olarak kabul etmezler. ⓘ
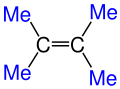
Burada Me ile gösterilen kısımlar Metil (CH3) grubunun Kısaltılmış halidir. ⓘ
Yapısal izomerizm
Dört veya daha fazla karbon atomuna sahip alkenler çeşitli yapısal izomerler oluşturabilir. Çoğu alken aynı zamanda sikloalkanların izomerleridir. Sadece bir çift bağa sahip asiklik alken yapısal izomerleri aşağıdaki gibidir:
- C2H4: sadece etilen
- C3H6: sadece propilen
- C4H8: 3 izomer: 1-büten, 2-büten ve izobüten
- C5H10: 5 izomer: 1-penten, 2-penten, 2-metil-1-büten, 3-metil-1-büten, 2-metil-2-büten
- C6H12: 13 izomer:
1-heksen,cis-2-heksen,trans-2-heksen,cis-3-heksen,trans-3-heksen,2 metil 1-penten, 3 metil 1-penten, 4 metil 1-penten,2 metil 2-penten, 3 metil 2-penten, 4 metil 2-penten, 2 3 dimetil 1-büten, 2 3 dimetil 2-büten
- C7H14: 27 izomer (hesaplanmış)
- C12H24: 2,281 izomer (hesaplanmış)
- C31H62: 193,706,542,776 izomer (hesaplanmış) ⓘ
Bu moleküllerin çoğu cis-trans izomerizm sergiler. Özellikle büyük moleküllerde (C5'ten itibaren) kiral karbon atomları da olabilir. Potansiyel izomerlerin sayısı ilave karbon atomları ile hızla artar. ⓘ
Yapı ve bağlanma
Yapıştırma

Bir karbon-karbon çift bağı, bir sigma bağı ve bir pi bağından oluşur. Bu çift bağ tek bir kovalent bağdan daha güçlüdür (C=C için 611 kJ/mol'e karşılık C-C için 347 kJ/mol), ancak iki kat daha güçlü değildir. Çift bağlar, tipik bir C-C tek bağı için 1,53 Å'a karşılık ortalama 1,33 Å (133 pm) bağ uzunluğu ile tek bağlardan daha kısadır. ⓘ
Çift bağın her bir karbon atomu, üç sp2 hibrit orbitalini kullanarak üç atomla (diğer karbon atomu ve iki hidrojen atomu) sigma bağı oluşturur. Üç sp² hibrit orbitalinin eksenleri tarafından oluşturulan düzleme dik uzanan hibritleşmemiş 2p atomik orbitalleri, pi bağını oluşturmak için birleşir. Bu bağ ana C-C ekseninin dışında yer alır ve bağın yarısı molekülün bir tarafında, yarısı da diğer tarafında bulunur. Pi bağı, 65 kcal/mol'lük gücüyle sigma bağından önemli ölçüde daha zayıftır. ⓘ
Karbon-karbon çift bağı etrafında dönme kısıtlıdır çünkü iki karbon atomu üzerindeki p orbitallerinin hizalanmasını bozmak enerjik bir maliyete neden olur. Sonuç olarak cis veya trans izomerleri o kadar yavaş birbirine dönüşür ki, ortam koşullarında izomerizasyon olmadan serbestçe işlenebilirler. Daha karmaşık alkenler, üç veya dört farklı sübstitüent (yan grup) içeren moleküller için E-Z notasyonu ile adlandırılabilir. Örneğin, bütenin izomerlerinden (Z)-but-2-enin (diğer adıyla cis-2-büten) iki metil grubu çift bağın aynı tarafında yer alırken, (E)-but-2-ende (diğer adıyla trans-2-büten) metil grupları zıt taraflarda yer alır. Bütenin bu iki izomeri farklı özelliklere sahiptir. ⓘ
Biri çift bağı çevirmek zor olsa da imkânsız değildir. Gerçekte, 90°lik bir çevirme işlemi pi bağının gücünün yarısına eşittir. P orbitallerinin yanlış yerleşimi beklenenden azdır çünkü piramidal yapı oluşmaya başlar. (Bkz: Piramidal alken) ⓘ
Şekil
VSEPR elektron çifti itme modelinin öngördüğü gibi, alkenlerin moleküler geometrisi, yaklaşık 120°'lik bir çift bağdaki her bir karbon atomu ile ilgili bağ açılarını içerir. Bu açı, çift bağın karbon atomlarına bağlı fonksiyonel gruplar arasındaki bağlanmamış etkileşimlerin getirdiği sterik gerilim nedeniyle değişebilir. Örneğin, propilendeki C-C-C bağ açısı 123,9°'dir. ⓘ
Köprülü alkenler için Bredt kuralı, halkalar yeterince büyük olmadığı sürece köprülü bir halka sisteminin köprü başında bir çift bağın oluşamayacağını belirtir. Fawcett'i takiben ve S'yi halkalardaki köprü başı olmayan atomların toplam sayısı olarak tanımlayarak, bisiklik sistemler kararlılık için S ≥ 7 ve trisiklik sistemler S ≥ 11 gerektirir. ⓘ
Fiziksel özellikler
Alkenlerin ve alkanların fiziksel özelliklerinin çoğu benzerdir: renksiz, polar olmayan ve yanıcıdırlar. Fiziksel durum moleküler kütleye bağlıdır: karşılık gelen doymuş hidrokarbonlar gibi, en basit alkenler (etilen, propilen ve büten) oda sıcaklığında gazdır. Yaklaşık beş ila on altı karbon atomlu doğrusal alkenler sıvıdır ve daha yüksek alkenler mumsu katılardır. Katıların erime noktası da moleküler kütle arttıkça artar. ⓘ
Alkenler genellikle karşılık gelen alkanlardan daha güçlü kokulara sahiptir. Etilenin tatlı ve küflü bir kokusu vardır. Memeli koku alma reseptörü MOR244-3'te kuprik iyonunun olefine bağlanması alkenlerin (ve tiyollerin) kokusunda rol oynar. Özellikle norbornen ve trans-siklookten gibi gergin alkenlerin güçlü, hoş olmayan kokulara sahip olduğu bilinmektedir; bu durum bakır dahil metal iyonları ile oluşturdukları daha güçlü π kompleksleri ile tutarlıdır. ⓘ
Reaksiyonlar
Alkenler nispeten kararlı bileşiklerdir, ancak alkanlardan daha reaktiftirler. Alkenlerin çoğu reaksiyonu, yeni tekli bağlar oluşturan bu pi bağına eklemeleri içerir. Alkenler, başta polimerizasyon ve alkilasyon olmak üzere çok çeşitli reaksiyonlara katılabildikleri için petrokimya endüstrisi için bir hammadde görevi görürler. ⓘ
Etilen hariç, alkenlerin iki reaktivite bölgesi vardır: karbon-karbon pi-bağı ve alilik CH merkezlerinin varlığı. Birincisi baskındır ancak alilik bölge de önemlidir. ⓘ
Ekleme reaksiyonları
Alkenler, çift bağın açılmasıyla gerçekleşen birçok katılma tepkimesinde reaksiyona girer. Bu katılma reaksiyonlarının çoğu elektrofilik katılma mekanizmasını takip eder. Örnek olarak hidrohalojenasyon, halojenasyon, halohidrin oluşumu, oksimerkürasyon, hidroborasyon, diklorokarben katılması, Simmons-Smith reaksiyonu, katalitik hidrojenasyon, epoksidasyon, radikal polimerizasyon ve hidroksilasyon verilebilir.
Hidrojenasyon ve ilgili hidroelementasyonlar
Alkenlerin hidrojenasyonu karşılık gelen alkanları üretir. Reaksiyon bazen basınç altında ve yüksek sıcaklıkta gerçekleştirilir. Metalik katalizörler neredeyse her zaman gereklidir. Yaygın endüstriyel katalizörler platin, nikel ve paladyum bazlıdır. Büyük ölçekli bir uygulama margarin üretimidir. ⓘ
Çift bağ boyunca H-H eklenmesinin yanı sıra, birçok başka H-X de eklenebilir. Bu işlemler genellikle büyük ticari öneme sahiptir. Bir örnek, H-SiR3 eklenmesi, yani hidrosililasyondur. Bu reaksiyon organosilikon bileşikleri üretmek için kullanılır. Diğer bir reaksiyon ise çift bağ boyunca H-CN ilavesi olan hidrosiyanasyondur. ⓘ
Hidrasyon
Hidrasyon, alkenlerin çift bağı boyunca su eklenmesi, alkolleri verir. Reaksiyon fosforik asit veya sülfürik asit ile katalize edilir. Bu reaksiyon sentetik etanol üretmek için endüstriyel ölçekte gerçekleştirilir. ⓘ
- CH2=CH2 + H2O → CH3-CH2OH ⓘ
Alkenler ayrıca oksimerkürasyon-demerkürasyon reaksiyonu, hidroborasyon-oksidasyon reaksiyonu veya Mukaiyama hidrasyonu yoluyla alkollere dönüştürülebilir. ⓘ
Halojenleme
Elektrofilik halojenasyonda alkenlere elementel brom veya klor eklenmesi sırasıyla vicinal dibromo- ve dikloroalkanlar (1,2-dihalidler veya etilen dihalidler) verir. Sudaki bir brom çözeltisinin renginin bozulması, alkenlerin varlığı için analitik bir testtir:
- CH2=CH2 + Br2 → BrCH2-CH2Br ⓘ
İlgili reaksiyonlar, bir bileşiğin veya karışımın brom sayısı ve iyot sayısı olarak ifade edilen doymamışlığın nicel ölçümleri olarak da kullanılır. ⓘ
Hidrohalojenasyon
Hidrohalojenasyon, HCl veya HI gibi hidrojen halojenürlerin alkenlere eklenerek karşılık gelen haloalkanların elde edilmesidir:
- CH3-CH=CH2 + HI → CH3-CHI-CH2-H ⓘ
Çift bağdaki iki karbon atomu farklı sayıda hidrojen atomuna bağlıysa, halojen tercihen daha az hidrojen sübstitüentine sahip karbonda bulunur. Bu model Markovnikov'un kuralı olarak bilinir. Radikal başlatıcıların veya diğer bileşiklerin kullanılması, ters ürün sonucuna yol açabilir. Özellikle hidrobromik asit, çeşitli safsızlıkların ve hatta atmosferik oksijenin varlığında radikaller oluşturmaya eğilimlidir ve bu da Markovnikov sonucunun tersine dönmesine yol açar:
- CH3-CH=CH2 + HBr → CH3-CHH-CH2-Br ⓘ
Halohidrin oluşumu
Alkenler su ve halojenlerle reaksiyona girerek bir ekleme reaksiyonu ile halohidrinler oluşturur. Markovnikov regiokimyası ve anti-stereokimya oluşur. ⓘ
- CH2=CH2 + X2 + H2O → XCH2-CH2OH + HX ⓘ
Oksidasyon
Alkenler perkarboksilik asitlerle ve hatta hidrojen peroksitle reaksiyona girerek epoksitler verir:
- RCH=CH2 + RCO3H → RCHOCH2 + RCO2H ⓘ
Etilen için epoksidasyon, katalizörlerin varlığında oksijen kullanılarak endüstriyel olarak çok büyük ölçekte gerçekleştirilir:
- C2H4 + 1/2 O2 → C2H4O ⓘ
Alkenler ozon ile reaksiyona girerek çift bağın kopmasına yol açar. Bu süreç ozonoliz olarak adlandırılır. Genellikle reaksiyon prosedürü dimetilsülfür (SMe2) gibi hafif bir indirgeyici içerir:
- RCH=CHR' + O3 + SMe2 → RCHO + R'CHO + O=SMe2
- R2C=CHR' + O3 → R2CHO + R'CHO + O=SMe2 ⓘ
Sıcak konsantre, asitlendirilmiş KMnO4 çözeltisi ile muamele edildiğinde, alkenler ketonlara ve/veya karboksilik asitlere ayrılır. Reaksiyonun stokiyometrisi koşullara duyarlıdır. Bu reaksiyon ve ozonoliz, bilinmeyen bir alken içindeki çift bağın konumunu belirlemek için kullanılabilir. ⓘ
Oksidasyon, osmiyum tetroksit veya diğer oksidanlar kullanılarak alkenin tamamen bölünmesi yerine vicinal diolde durdurulabilir:
- R'CH=CR2 + 1/2 O2 + H2O → R'CH(OH)-C(OH)R2
Bu reaksiyona dihidroksilasyon denir. ⓘ
Metilen mavisi ve ışık gibi uygun bir fotosensitizör varlığında alkenler hidroksil radikalleri, singlet oksijen veya süperoksit iyonu gibi fotosensitizör tarafından üretilen reaktif oksijen türleri ile reaksiyona girebilir. Uyarılmış hassaslaştırıcının reaksiyonları, genellikle indirgeyici bir substratla (Tip I reaksiyon) veya oksijenle etkileşimle (Tip II reaksiyon) elektron veya hidrojen transferini içerebilir. Bu çeşitli alternatif süreçler ve reaksiyonlar, çok çeşitli ürünlere yol açan belirli reaksiyon koşullarının seçimi ile kontrol edilebilir. Yaygın bir örnek, bir endoperoksit vermek üzere singlet oksijenin siklopentadien gibi bir dien ile [4+2]-cycloaddition reaksiyonudur:
Diğer bir örnek ise singlet oksijenin bir alilik yapı ile reaksiyona girerek transpoze bir alil peroksit verdiği Schenck ene reaksiyonudur:
Alkenler büyük sayıdaki yükseltgenler ile oksitlenebilirler.
- Oksijenin varlığında alkenler karbondioksit ve su açığa çıkaracak şekilde açık bir alevle yanarlar.
- Oksijenle katalitik oksidasyon veya perkarboksilik asitlerle reaksiyonda epoksitler oluşur.
- ozonoliz'de ozonla gerçekleştirilen reaksiyon çift bağların kırılmasına yol açar ve açığa iki aldehid veya keton çıkar.
- R1-CH=CH-R2 + O3 → R1-CHO + R2-CHO + H2O
- Bu reaksiyon bilinmeyen bir alkenin çift bağlarının pozisyonlarını belirlemede kullanılabilir. ⓘ
Polimerizasyon
Terminal alkenler, polimerizasyon olarak adlandırılan süreçler yoluyla polimerlerin öncüleridir. Bazı polimerizasyonlar, polietilen ve polipropilen gibi plastikler ürettikleri için büyük ekonomik öneme sahiptir. Alkenlerden elde edilen polimerler, olefin içermemelerine rağmen genellikle poliolefin olarak adlandırılırlar. Polimerizasyon farklı mekanizmalarla gerçekleşebilir. buta-1,3-dien ve izopren (2-metilbuta-1,3-dien) gibi konjuge dienler de polimerler üretir, bir örnek doğal kauçuktur. ⓘ
Alkenlerin polimerizasyonu polietilen ve polipropilen plastikleri gibi yüksek endüstri değerli polimerleri açığa çıkaran ekonomik olarak önemli bir reaksiyondur. Polimerizasyon hem köksüz hem de iyonik olarak devam edebilen bir mekanizmadır. ⓘ
Metal kompleksleşmesi
Alkenler, geçiş metali alken komplekslerindeki ligandlardır. İki karbon merkezi C-C pi- ve pi* orbitallerini kullanarak metale bağlanır. Mono- ve diolefinler genellikle kararlı komplekslerde ligand olarak kullanılır. Siklooktadien ve norbornadien popüler şelatlama ajanlarıdır ve hatta etilenin kendisi de bazen, örneğin Zeise tuzunda, ligand olarak kullanılır. Buna ek olarak, metal-alken kompleksleri hidrojenasyon, hidroformilasyon ve polimerizasyon dahil olmak üzere birçok metal katalizli reaksiyonda ara ürünlerdir. ⓘ
Reaksiyona genel bakış
| Reaksiyon adı | Ürün | Yorum ⓘ |
|---|---|---|
| Hidrojenasyon | alkanlar | hidrojen ilavesi |
| Hidroalkenilasyon | alkenler | metal katalizör ile hidrometalasyon / ekleme / beta-eliminasyon |
| Halojen ekleme reaksiyonu | 1,2-dihalid | halojenlerin elektrofilik katılması |
| Hidrohalojenasyon (Markovnikov) | haloalkanlar | hidrohalik asitlerin eklenmesi |
| Anti-Markovnikov hidrohalojenasyon | haloalkanlar | hidrohalik asitlerin serbest radikaller aracılığı ile eklenmesi |
| Hidroaminasyon | aminler | C-C çift bağı boyunca N-H bağının eklenmesi |
| Hidroformilasyon | aldehitler | endüstriyel proses, CO ve H2 ilavesi |
| Hidrokarboksilasyon ve Koch reaksiyonu | karboksilik asit | endüstriyel proses, CO ve H2O ilavesi. |
| Karboalkoksilasyon | Ester | endüstriyel proses, CO ve alkol ilavesi. |
| alkilasyon | Ester | Endüstriyel proses: katalizör olarak silikotungstik asit ile alken alkilleyici karboksilik asit. |
| Keskin olmayan bishidroksilasyon | dioller | oksidasyon, reaktif: osmiyum tetroksit, kiral ligand |
| Woodward cis-hidroksilasyonu | dioller | oksidasyon, reaktifler: iyot, gümüş asetat |
| Ozonoliz | aldehitler veya ketonlar | reaktif: ozon |
| Olefin metatezi | alkenler | iki alken iki yeni alken oluşturmak üzere yeniden düzenlenir |
| Diels-Alder reaksiyonu | sikloheksenler | bir dien ile siklokatılma |
| Pauson-Khand reaksiyonu | siklopentenonlar | bir alkin ve CO ile siklokatılma |
| Hidroborasyon-oksidasyon | alkoller | reaktifler: boran, sonra bir peroksit |
| Oksimerkürasyon-indirgeme | alkoller | merkürik asetatın elektrofilik eklenmesi, ardından indirgenmesi |
| Prins tepkisi | 1,3-dioller | aldehit veya keton ile elektrofilik katılma |
| Paterno-Büchi reaksiyonu | oksetanlar | aldehit veya keton ile fotokimyasal reaksiyon |
| Epoksidasyon | epoksit | bir peroksitin elektrofilik katılması |
| Siklopropanasyon | siklopropanlar | karbenlerin veya karbenoitlerin eklenmesi |
| Hidroasilasyon | ketonlar | metal katalizör ile oksidatif ekleme / redüktif eliminasyon |
| Hidrofosfinasyon | fosfinler |
Sentez
Endüstriyel yöntemler
Alkenler hidrokarbon krakingi ile üretilir. Hammaddeler çoğunlukla ABD ve Ortadoğu'da doğal gaz kondensat bileşenleri (esas olarak etan ve propan) ve Avrupa ve Asya'da naftadır. Alkanlar yüksek sıcaklıklarda, genellikle bir zeolit katalizörü varlığında, öncelikle alifatik alkenler ve daha düşük moleküler ağırlıklı alkanların bir karışımını üretmek için parçalanır. Karışım hammaddeye ve sıcaklığa bağlıdır ve fraksiyonel damıtma ile ayrılır. Bu esas olarak küçük alkenlerin (altı karbona kadar) üretimi için kullanılır. ⓘ
Bununla ilgili olarak, bir alkanın karşılık gelen bir alken üretmek için yüksek sıcaklıklarda hidrojen kaybettiği katalitik dehidrojenasyondur. Bu, alkenlerin katalitik hidrojenasyonunun tersidir. ⓘ
Bu süreç reforming olarak da bilinir. Her iki süreç de endotermiktir ve entropi tarafından yüksek sıcaklıklarda alkene doğru yönlendirilir. ⓘ
Yüksek α-alkenlerin (RCH=CH2 tipinde) katalitik sentezi, nikel, kobalt veya platin varlığında organometalik bileşik trietilalüminyum ile etilenin reaksiyonu ile de elde edilebilir. ⓘ
Eliminasyon reaksiyonları
Laboratuvarda alken sentezi için temel yöntemlerden biri alkil halojenürlerin, alkollerin ve benzer bileşiklerin oda eliminasyonudur. En yaygın olanı E2 veya E1 mekanizması yoluyla β-eliminasyonudur, ancak α-eliminasyonlar da bilinmektedir. ⓘ
E2 mekanizması, çoğu alken sentezi için E1'den daha güvenilir bir β-eliminasyon yöntemi sağlar. Çoğu E2 eliminasyonu bir alkil halojenür veya alkil sülfonat esteri (tosilat veya triflat gibi) ile başlar. Bir alkil halojenür kullanıldığında, reaksiyon dehidrohalojenasyon olarak adlandırılır. Simetrik olmayan ürünler için, daha sübstitüe alkenler (C=C'ye bağlı daha az hidrojeni olanlar) baskın olma eğilimindedir (bkz. Zaitsev kuralı). Eliminasyon reaksiyonlarının iki yaygın yöntemi alkil halojenürlerin dehidrohalojenasyonu ve alkollerin dehidrasyonudur. Tipik bir örnek aşağıda gösterilmiştir; mümkünse, daha az kararlı Z-izomerine yol açsa bile, H'nin ayrılan gruba karşı olduğuna dikkat edin. ⓘ
Alkenler alkollerden dehidrasyon yoluyla sentezlenebilir, bu durumda su E1 mekanizması yoluyla kaybedilir. Örneğin, etanolün dehidrasyonu etilen üretir:
- CH3CH2OH → H2C=CH2 + H2O ⓘ
Bir alkol, Chugaev eliminasyonu ve Grieco eliminasyonu gibi daha hafif bir sin-eliminasyona izin verecek şekilde daha iyi bir ayrılma grubuna (örneğin ksantat) da dönüştürülebilir. İlgili reaksiyonlar β-haloeterler (Boord olefin sentezi) ve esterler (ester pirolizi) ile eliminasyonları içerir. ⓘ
Alkenler, alkil aminlerden dolaylı olarak hazırlanabilir. Amin veya amonyak uygun bir ayrılma grubu değildir, bu nedenle amin önce ya alkilleştirilir (Hofmann eliminasyonunda olduğu gibi) ya da düzgün bir eliminasyonu mümkün kılmak için bir amin okside oksitlenir (Cope reaksiyonu). Cope reaksiyonu, örneğin 150 °C'de veya altında gerçekleşen bir sin-eliminasyondur:
Hofmann eliminasyonu, daha az sübstitüe (Zaitsev olmayan) alkenin genellikle ana ürün olması nedeniyle olağandışıdır. ⓘ
Alkenler, Ramberg-Bäcklund reaksiyonunda α-halosülfonlardan üç üyeli halka sülfon ara maddesi yoluyla üretilir. ⓘ
Karbonil bileşiklerinden sentez
Alken sentezi için bir diğer önemli yöntem, bir karbonil bileşiğinin (bir aldehit veya keton gibi) bir karbanyon eşdeğerine bağlanmasıyla yeni bir karbon-karbon çift bağının oluşturulmasını içerir. Bu tür reaksiyonlar bazen olefinasyonlar olarak adlandırılır. Bu yöntemlerden en iyi bilineni Wittig reaksiyonudur, ancak Horner-Wadsworth-Emmons reaksiyonu da dahil olmak üzere diğer ilgili yöntemler de bilinmektedir. ⓘ
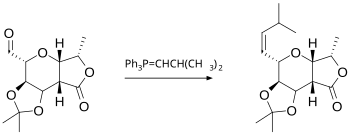
Wittig reaksiyonu, bir aldehit veya ketonun Ph3P=CHR tipinde bir Wittig reaktifi (veya fosforan) ile bir alken ve Ph3P=O üretmek üzere reaksiyonunu içerir. Wittig reaktifinin kendisi trifenilfosfin ve bir alkil halojenürden kolayca hazırlanır. Reaksiyon oldukça geneldir ve bu örnekte olduğu gibi esterler de dahil olmak üzere birçok fonksiyonel grup tolere edilir:
Wittig reaksiyonu ile ilgili olarak, fosforan yerine silikon bazlı reaktiflerin kullanıldığı Peterson olefinasyonudur. Bu reaksiyon E- veya Z-ürünlerinin seçilmesine olanak sağlar. Bir E-ürünü isteniyorsa, başka bir alternatif de bir fenil sülfondan üretilen karbanyonu kullanan Julia olefinasyonudur. Bir organokrom ara ürününe dayanan Takai olefinasyonu da E-ürünleri verir. Tebbe'nin reaktifi olan bir titanyum bileşiği, metilen bileşiklerinin sentezi için kullanışlıdır; bu durumda esterler ve amidler bile reaksiyona girer. ⓘ
Bir alken oluşturmak için bir çift keton veya aldehit oksijensizleştirilebilir. Simetrik alkenler, titanyum metal indirgenmesi (McMurry reaksiyonu) kullanılarak tek bir aldehit veya ketonun kendisiyle birleşmesinden hazırlanabilir. Farklı ketonlar birleştirilecekse, Barton-Kellogg reaksiyonu gibi daha karmaşık bir yöntem gereklidir. ⓘ
Tek bir keton da sodyum metoksit (Bamford-Stevens reaksiyonu) veya bir alkilityum (Shapiro reaksiyonu) kullanılarak tosilhidrazon aracılığıyla karşılık gelen alkene dönüştürülebilir. ⓘ
Alkenlerden sentez
Daha küçük alkenlerin aşamalı polimerizasyonu yoluyla daha uzun alkenlerin oluşumu caziptir, çünkü etilen (en küçük alken) hem ucuzdur hem de yılda yüz milyonlarca ton üretilerek kolayca temin edilebilir. Ziegler-Natta prosesi, örneğin polietilen için kullanılanlar gibi çok uzun zincirlerin oluşumuna izin verir. Yüzey aktif maddelerin üretiminde olduğu gibi daha kısa zincirler istendiğinde, Shell yüksek olefin prosesi gibi bir olefin metatezi adımı içeren prosesler önemlidir. ⓘ
Olefin metatezi ticari olarak etilen ve 2-butenin propilene dönüştürülmesi için de kullanılmaktadır. Bu süreçte renyum ve molibden içeren heterojen katalizörler kullanılmaktadır:
- CH2=CH2 + CH3CH=CHCH3 → 2 CH2=CHCH3 ⓘ
Geçiş metali katalizli hidrovinilasyon, alkenin kendisinden başlayan bir diğer önemli alken sentez işlemidir. Bir çift bağ boyunca bir hidrojen ve bir vinil grubunun (veya bir alkenil grubunun) eklenmesini içerir. ⓘ
Alkinlerden
Alkinlerin indirgenmesi, disübstitüe alkenlerin stereoselektif sentezi için kullanışlı bir yöntemdir. Eğer cis-alken isteniyorsa, Lindlar katalizörü (kalsiyum karbonat üzerine biriktirilmiş ve çeşitli kurşun formlarıyla işlenmiş paladyumdan oluşan heterojen bir katalizör) varlığında hidrojenasyon yaygın olarak kullanılır, ancak hidroborasyon ve ardından hidroliz alternatif bir yaklaşım sağlar. Alkinlerin sıvı amonyak içinde sodyum metali ile indirgenmesi trans-alkeni verir. ⓘ
Çoklu sübstitüe alkenlerin hazırlanması için, alkinlerin karbometalasyonu çok çeşitli alken türevlerinin ortaya çıkmasına neden olabilir. ⓘ
Yeniden düzenlenmeler ve ilgili reaksiyonlar
Alkenler, yeniden düzenleme reaksiyonları yoluyla diğer alkenlerden sentezlenebilir. Olefin metatezinin (yukarıda açıklanmıştır) yanı sıra, ene reaksiyonu ve Cope yeniden düzenlemesi gibi birçok perisiklik reaksiyon kullanılabilir. ⓘ
Diels-Alder reaksiyonunda, bir dien ve reaktif veya elektron eksikliği olan bir alkenden bir sikloheksen türevi hazırlanır. ⓘ
IUPAC İsimlendirmesi
İsimlendirme yaygın olarak takip edilmese de, IUPAC'a göre bir alken, karbon atomları arasında sadece bir çift bağ bulunan asiklik bir hidrokarbondur. Olefinler, siklik ve asiklik alkenlerin yanı sıra dienler ve polienlerin daha geniş bir koleksiyonunu oluşturur. ⓘ
Düz zincirli alkenlerin IUPAC isimlerinin kökünü oluşturmak için, ebeveynin -an- ekini -en- olarak değiştirin. Örneğin, CH3-CH3 alkan ethANe'dir. Bu nedenle CH2=CH2'nin adı ethENe'dir. ⓘ
Karbon atomu sayısı 4 veya daha fazla olan düz zincirli alkenler için bu isim bileşiği tam olarak tanımlamaz. Bu durumlarda ve dallanmış asiklik alkenler için aşağıdaki kurallar geçerlidir:
- Moleküldeki en uzun karbon zincirini bulun. Eğer bu zincir çift bağ içermiyorsa, bileşiği alkan adlandırma kurallarına göre adlandırın. Aksi takdirde:
- Bu zincirdeki karbonları çift bağa en yakın uçtan başlayarak numaralandırın.
- Çift bağın k konumunu ilk karbonun numarası olarak tanımlayın.
- Yan grupları (hidrojen dışındaki) uygun kurallara göre adlandırın.
- Her bir yan grubun konumunu, bağlı olduğu zincir karbonunun numarası olarak tanımlayınız.
- Her bir yan grubun konumunu ve adını yazınız.
- Aynı zincire sahip alkanların isimlerini, "-ane" son ekini "k-ene" ile değiştirerek yazınız. ⓘ
Çift bağın konumu genellikle son ekten önce ("pent-2-ene") değil, zincirin adından önce (örneğin "2-penten") eklenir. ⓘ
Konumlar benzersiz ise belirtilmelerine gerek yoktur. Çift bağın, karşılık gelen alkan için kullanılandan farklı bir zincir numaralandırması anlamına gelebileceğini unutmayın: (H
3C)
3C-CH
2-CH
3 "2,2-dimetil pentan" iken, (H
3C)
3C-CH=CH
2 "3,3-dimetil 1-penten "dir. ⓘ
Polienler ve sikloalkenler için daha karmaşık kurallar geçerlidir. ⓘ

Cis-trans izomerizmi
Eğer asiklik bir mono-enin çift bağı zincirin ilk bağı değilse, cis-trans izomerizm nedeniyle yukarıda verilen isim yine de bileşiği tam olarak tanımlamaz. O zaman çift bağa bitişik iki tek C-C bağının düzleminin aynı tarafında mı yoksa zıt taraflarında mı olduğu belirtilmelidir. Monoalkenler için konfigürasyon genellikle isimden önce sırasıyla cis- (Latince "bu tarafında") veya trans- ("karşısında", "diğer tarafında") ön ekleriyle belirtilir; cis-2-penten veya trans-2-bütende olduğu gibi. ⓘ

Daha genel olarak, cis-trans izomerizmi, çift bağdaki iki karbondan her birinin kendisine bağlı iki farklı atom veya gruba sahip olması durumunda var olacaktır. Bu durumları hesaba katan IUPAC, cis ve trans önekleri yerine daha genel olan E-Z gösterimini önermektedir. Bu gösterim, iki karbonun her birinde en yüksek CIP önceliğine sahip grubu dikkate alır. Eğer bu iki grup çift bağ düzleminin zıt taraflarındaysa, konfigürasyon E (Almanca entgegen, "zıt") olarak etiketlenir; eğer aynı taraftaysa, Z (Almanca zusammen, "birlikte") olarak etiketlenir. Bu etiketleme "Z, 'ze zame zide' anlamına gelir" anımsatıcısıyla öğretilebilir. ⓘ

C=C çift bağ içeren gruplar
IUPAC, karbon-karbon çift bağları içeren hidrokarbon grupları için iki isim tanımaktadır: vinil grubu ve alil grubu. ⓘ
Ayrıca bakınız
- Alfa-olefin
- Annulene
- Aromatik hidrokarbon ("Arene")
- Dendralene
- Nitroalken
- Radialene ⓘ
İsimlendirme bağlantıları
- Kural A-3. Doymamış Bileşikler ve Tek Değerlikli Radikaller [1] IUPAC Mavi Kitap.
- Kural A-4. İki Değerlikli ve Çok Değerlikli Radikaller [2] IUPAC Mavi Kitap.
- Kurallar A-11.3, A-11.4, A-11.5 Doymamış monosiklik hidrokarbonlar ve sübstitüentler [3] IUPAC Mavi Kitap.
- Kural A-23. Kaynaşmış Polisiklik Hidrokarbonların Hidrojenlenmiş Bileşikleri [4] IUPAC Mavi Kitap. ⓘ
Yapıları
Şekilleri
VSEPR teorisiyle varsayıldığı üzere alkenlerde çift bağ yapan karbon atomlarının arasında yaklaşık 120° açı oluşmaktadır. Bu açı Van der Waals etkileşimleri ve bağa katılmayan fonksiyonel grupların etkileri ile değişebilir. Örnek olarak propen molekülünde bağ açısı 123.9° dir. Alken çift bağı tekli kovalent bağdan daha güçlüdür ve 133 pikometre daha kısadır. ⓘ
Alkenlerin Özellikleri
Alkenler etenden bütene kadar olanlar gaz , 5 karbonlu pentenden 15 karbonlu Pentadekene kadar olanlar sıvı ve yapısında 15’den fazla karbon bulunduran alkenler ise normal şartlar altında katı haldedirler. Alkenler suda zor çözülen organik bileşiklerdir. Karbon- karbon arasındaki tekli bağlar karbon-karbon çift bağlara göre daha kuvvetlidirler. Bu yüzden alkenlerde yapılarındaki çift bağları bozma eğilimi vardır. Bundan dolayı alkenler reaktifdirler. Alkenler halojenlerle halojenalkanlere dönüşürler. Alkenler petrokimya endüstrisinde katkı malzemesi olarak kullanılmaktadır çünkü birçok reaksiyona katılabilme özelliğine sahiptirler. ⓘ





![Generation of singlet oxygen and its [4+2]-cycloaddition with cyclopentadiene](https://upload.wikimedia.org/wikipedia/commons/thumb/1/12/4%2B2_cycloaddition_cyclopentadiene_O2.svg/langtr-350px-4%2B2_cycloaddition_cyclopentadiene_O2.svg.png)