Alüminyum
 | ||||||||||||||||||||
| Alüminyum | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Telaffuz | ||||||||||||||||||||
| Alternatif isim | alüminyum (ABD, Kanada) | |||||||||||||||||||
| Görünüş | gümüşi gri metalik | |||||||||||||||||||
| Standart atom ağırlığı Ar°(Al) |
| |||||||||||||||||||
| Periyodik tabloda alüminyum | ||||||||||||||||||||
| ||||||||||||||||||||
| Atom numarası (Z) | 13 | |||||||||||||||||||
| Grup | grup 13 (bor grubu) | |||||||||||||||||||
| Dönem | dönem 3 | |||||||||||||||||||
| Blok | p-blok | |||||||||||||||||||
| Elektron konfigürasyonu | [[[Neon|Ne]]] 3s2 3p1 | |||||||||||||||||||
| Kabuk başına elektron | 2, 8, 3 | |||||||||||||||||||
| Fiziksel özellikler | ||||||||||||||||||||
| STP'de Faz | katı | |||||||||||||||||||
| Erime noktası | 933,47 K (660,32 °C, 1220,58 °F) | |||||||||||||||||||
| Kaynama noktası | 2743 K (2470 °C, 4478 °F) | |||||||||||||||||||
| Yoğunluk (r.t.'ye yakın) | 2,70 g/cm3 | |||||||||||||||||||
| sıvı olduğunda (m.p.'de) | 2.375 g/cm3 | |||||||||||||||||||
| Füzyon ısısı | 10,71 kJ/mol | |||||||||||||||||||
| Buharlaşma ısısı | 284 kJ/mol | |||||||||||||||||||
| Molar ısı kapasitesi | 24,20 J/(mol-K) | |||||||||||||||||||
Buhar basıncı
| ||||||||||||||||||||
| Atomik özellikler | ||||||||||||||||||||
| Oksidasyon durumları | -2, -1, +1, +2, +3 (amfoterik bir oksit) | |||||||||||||||||||
| Elektronegatiflik | Pauling ölçeği: 1.61 | |||||||||||||||||||
| İyonlaşma enerjileri |
| |||||||||||||||||||
| Atomik yarıçap | ampi̇ri̇k: 143 pm | |||||||||||||||||||
| Kovalent yarıçap | 121±4 pm | |||||||||||||||||||
| Van der Waals yarıçapı | 184 pm | |||||||||||||||||||
| Alüminyumun spektral çizgileri | ||||||||||||||||||||
| Diğer özellikler | ||||||||||||||||||||
| Doğal oluşum | ilkel | |||||||||||||||||||
| Kristal yapı | yüz merkezli kübik (fcc) | |||||||||||||||||||
| Ses hızı ince çubuk | (haddelenmiş) 5000 m/s (r.t.'de) | |||||||||||||||||||
| Termal genleşme | 23,1 µm/(m⋅K) (25 °C'de) | |||||||||||||||||||
| Termal iletkenlik | 237 W/(m⋅K) | |||||||||||||||||||
| Elektriksel direnç | 26,5 nΩ⋅m (20 °C'de) | |||||||||||||||||||
| Manyetik sıralama | paramanyetik | |||||||||||||||||||
| Molar manyetik duyarlılık | +16,5×10-6 cm3/mol | |||||||||||||||||||
| Young modülü | 70 GPa | |||||||||||||||||||
| Kayma modülü | 26 GPa | |||||||||||||||||||
| Yığın modülü | 76 GPa | |||||||||||||||||||
| Poisson oranı | 0.35 | |||||||||||||||||||
| Mohs sertliği | 2.75 | |||||||||||||||||||
| Vickers sertliği | 160-350 MPa | |||||||||||||||||||
| Brinell sertliği | 160-550 MPa | |||||||||||||||||||
| CAS Numarası | 7429-90-5 | |||||||||||||||||||
| Tarih | ||||||||||||||||||||
| İsimlendirme | alumine'den, alüminanın eski adı | |||||||||||||||||||
| Tahmin | Antoine Lavoisier (1782) | |||||||||||||||||||
| Keşif | Hans Christian Ørsted (1824) | |||||||||||||||||||
| İsimlendiren | Humphry Davy (1812) | |||||||||||||||||||
| Alüminyumun ana izotopları | ||||||||||||||||||||
| ||||||||||||||||||||
Alüminyum (Amerikan ve Kanada İngilizcesinde alüminyum), Al sembolüne ve 13 atom numarasına sahip kimyasal bir elementtir. Alüminyumun yoğunluğu diğer yaygın metallerden daha düşük olup çeliğin yaklaşık üçte biri kadardır. Oksijene karşı büyük bir afinitesi vardır ve havaya maruz kaldığında yüzeyinde koruyucu bir oksit tabakası oluşturur. Alüminyum, hem rengi hem de ışığı yansıtma kabiliyeti bakımından görsel olarak gümüşe benzer. Yumuşak, manyetik olmayan ve sünektir. Kararlı bir izotopu vardır, 27Al; bu izotop çok yaygındır ve alüminyumu evrendeki en yaygın on ikinci element yapar. 26Al'in radyoaktivitesi radyodizasyonda kullanılır. ⓘ
Kimyasal olarak alüminyum, bor grubunda geçiş sonrası bir metaldir; grup için yaygın olduğu gibi, alüminyum öncelikle +3 oksidasyon durumunda bileşikler oluşturur. Alüminyum katyonu Al3+ küçük ve yüksek yüklüdür; bu nedenle kutuplaştırıcıdır ve alüminyumun oluşturduğu bağlar kovalent olma eğilimindedir. Oksijene olan güçlü yakınlığı, alüminyumun doğada oksijenle oksitler şeklinde yaygın olarak birleşmesine yol açar; bu nedenle alüminyum, Dünya'da mantodan ziyade oksijen ve silikondan sonra en bol bulunan üçüncü element olduğu kabuktaki kayalarda bulunur ve neredeyse hiçbir zaman serbest metal olarak bulunmaz. ⓘ
Alüminyumun keşfi 1825 yılında Danimarkalı fizikçi Hans Christian Ørsted tarafından duyurulmuştur. Alüminyumun ilk endüstriyel üretimi 1856 yılında Fransız kimyager Henri Étienne Sainte-Claire Deville tarafından başlatılmıştır. Alüminyum, 1886 yılında Fransız mühendis Paul Héroult ve Amerikalı mühendis Charles Martin Hall tarafından bağımsız olarak geliştirilen Hall-Héroult süreci ile halka çok daha açık hale geldi ve alüminyumun seri üretimi, endüstride ve günlük yaşamda yaygın olarak kullanılmasına yol açtı. Birinci ve İkinci Dünya Savaşlarında alüminyum, havacılık için çok önemli bir stratejik kaynak olmuştur. 1954 yılında alüminyum, bakırı geçerek en çok üretilen demir dışı metal haline geldi. 21. yüzyılda alüminyumun çoğu Amerika Birleşik Devletleri, Batı Avrupa ve Japonya'da ulaşım, mühendislik, inşaat ve ambalajlama alanlarında tüketilmiştir. ⓘ
Çevredeki yaygınlığına rağmen, hiçbir canlı organizmanın alüminyum tuzlarını metabolik olarak kullandığı bilinmemektedir, ancak alüminyum bitkiler ve hayvanlar tarafından iyi tolere edilmektedir. Bu tuzların bolluğu nedeniyle, biyolojik bir rol oynama potansiyeli sürekli ilgi çekmektedir ve çalışmalar devam etmektedir. ⓘ
Alüminyum, atom numarası 13 ve simgesi Al olan kimyasal element. Gümüş renkte, sünek bir metaldir. Doğada genellikle boksit cevheri halinde bulunur ve oksidasyona karşı üstün direnci ile tanınır. Bu direncin temelinde pasivasyon özelliği yatar. Endüstrinin pek çok kolunda milyonlarca farklı ürünün yapımında kullanılmakta olup dünya ekonomisi içinde çok önemli bir yeri vardır. Alüminyumdan üretilmiş yapısal bileşenler uzay ve havacılık sanayii için vazgeçilmezdir. Hafiflik ve yüksek dayanım özellikleri gerektiren taşımacılık ve inşaat sanayiinde geniş kullanım alanı bulur. ⓘ
Fiziksel özellikler
İzotoplar
Alüminyum izotoplarından sadece 27'si
Al
kararlıdır. Bu durum, atom numarası tek olan elementler için yaygındır. Tek ilkel alüminyum izotopudur, yani gezegenin oluşumundan bu yana Dünya'da mevcut haliyle var olan tek izotoptur. Dünya üzerindeki alüminyumun neredeyse tamamı bu izotop olarak bulunur, bu da onu mononüklidik bir element yapar ve standart atom ağırlığının izotopunkiyle neredeyse aynı olduğu anlamına gelir. Tek kararlı izotopu yüksek NMR hassasiyetine sahip olduğundan, bu durum alüminyumu nükleer manyetik rezonansta (NMR) çok kullanışlı hale getirir. Alüminyumun standart atom ağırlığı diğer birçok metale kıyasla düşüktür. ⓘ
Alüminyumun diğer tüm izotopları radyoaktiftir. Bunlardan en kararlısı 26Al'dir: Güneş Sistemi'nin oluştuğu yıldızlararası ortamda kararlı 27Al ile birlikte bulunmasına ve yıldız nükleosentezi ile üretilmesine rağmen, yarı ömrü sadece 717.000 yıldır ve bu nedenle gezegenin oluşumundan bu yana tespit edilebilir bir miktar kalmamıştır. Bununla birlikte, kozmik ışın protonlarının neden olduğu parçalanma ile atmosferdeki argondan çok küçük 26Al izleri üretilmektedir. 26Al'ın 10Be'ye oranı, 105 ila 106 yıllık zaman ölçeklerinde jeolojik süreçlerin, özellikle de taşınma, çökelme, tortu depolama, gömülme süreleri ve erozyonun radyodatasyonu için kullanılmıştır. Meteorit bilimcilerinin çoğu, 26Al'nin bozunmasıyla açığa çıkan enerjinin, 4.55 milyar yıl önce oluşumlarından sonra bazı asteroitlerin erimesinden ve farklılaşmasından sorumlu olduğuna inanmaktadır. ⓘ
Kütle numaraları 22 ila 43 arasında değişen alüminyumun geri kalan izotoplarının hepsinin yarı ömürleri bir saatin altındadır. Yarı ömürleri bir dakikanın altında olan üç metastabil durum bilinmektedir. ⓘ
Elektron kabuğu
Bir alüminyum atomu, [[[Neon|Ne]]] 3s2 3p1 elektron konfigürasyonunda düzenlenmiş 13 elektrona sahiptir ve üç elektronu kararlı bir soygaz konfigürasyonunun ötesindedir. Buna göre, alüminyumun birleşik ilk üç iyonlaşma enerjisi, tek başına dördüncü iyonlaşma enerjisinden çok daha düşüktür. Böyle bir elektron konfigürasyonu, grubunun diğer iyi karakterize edilmiş üyeleri olan bor, galyum, indiyum ve talyum ile paylaşılır; nihonyum için de beklenir. Alüminyum birçok kimyasal reaksiyonda en dıştaki üç elektronunu nispeten kolaylıkla verebilir (aşağıya bakınız). Alüminyumun elektronegatifliği 1.61'dir (Pauling ölçeği). ⓘ

Serbest bir alüminyum atomunun yarıçapı 143 pm'dir. En dıştaki üç elektron çıkarıldığında, yarıçap 4 koordinatlı bir atom için 39 pm'ye veya 6 koordinatlı bir atom için 53,5 pm'ye küçülür. Standart sıcaklık ve basınçta, alüminyum atomları (diğer elementlerin atomlarından etkilenmediğinde) atomların en dış elektronları tarafından sağlanan metalik bağ ile bağlı yüz merkezli kübik bir kristal sistemi oluşturur; dolayısıyla alüminyum (bu koşullarda) bir metaldir. Bu kristal sistemi kurşun ve bakır gibi diğer birçok metal tarafından paylaşılır; alüminyumun birim hücresinin boyutu bu diğer metallerinkiyle karşılaştırılabilir. Ancak bu sistem grubun diğer üyeleri tarafından paylaşılmaz; borun iyonlaşma enerjileri metalleşmeye izin vermeyecek kadar yüksektir, talyum altıgen sıkı paketlenmiş bir yapıya sahiptir, galyum ve indiyum ise alüminyum ve talyum gibi sıkı paketlenmemiş olağandışı yapılara sahiptir. Alüminyum metalinde metalik bağlanma için mevcut olan az sayıdaki elektron, düşük erime noktası ve düşük elektrik direnci ile yumuşak olmasının muhtemel bir nedenidir. ⓘ
Dökme
Alüminyum metal, yüzey pürüzlülüğüne bağlı olarak gümüşi beyazdan donuk griye kadar değişen bir görünüme sahiptir. Alüminyum aynalar, yakın ultraviyole ve uzak kızılötesi ışık için tüm metal aynalar arasında en yansıtıcı olanıdır ve görünür spektrumda en yansıtıcı olanlardan biridir, neredeyse gümüş ile eşittir ve bu nedenle ikisi benzer görünür. Alüminyum güneş radyasyonunu yansıtmada da iyidir, ancak havada güneş ışığına uzun süre maruz kalmak metalin yüzeyinde aşınmaya neden olur; alüminyum anodize edilirse bu önlenebilir, bu da yüzeye koruyucu bir oksit tabakası ekler. ⓘ
Alüminyumun yoğunluğu 2,70 g/cm3 olup çeliğin yaklaşık 1/3'ü kadardır ve yaygın olarak karşılaşılan diğer metallerden çok daha düşüktür, bu da alüminyum parçaların hafiflikleriyle kolayca tanımlanabilmesini sağlar. Alüminyumun diğer metallerin çoğuna kıyasla düşük yoğunluğu, çekirdeklerinin çok daha hafif olmasından kaynaklanırken, birim hücre boyutundaki farklılık bu farkı telafi etmez. Daha hafif olan tek metaller, berilyum ve magnezyum dışında yapısal kullanım için fazla reaktif olan (ve berilyum çok zehirli olan) 1. ve 2. grup metallerdir. Alüminyum çelik kadar güçlü veya sert değildir, ancak düşük yoğunluğu havacılık ve uzay endüstrisinde ve hafif ve nispeten yüksek mukavemetin çok önemli olduğu diğer birçok uygulamada bunu telafi eder. ⓘ
Saf alüminyum oldukça yumuşaktır ve mukavemetten yoksundur. Çoğu uygulamada bunun yerine daha yüksek mukavemet ve sertliklerinden dolayı çeşitli alüminyum alaşımları kullanılır. Saf alüminyumun akma dayanımı 7-11 MPa iken, alüminyum alaşımları 200 MPa ile 600 MPa arasında değişen akma dayanımına sahiptir. Alüminyum, %50-70 uzama yüzdesiyle sünektir ve kolayca çekilip ekstrüde edilebilmesini sağlayan dövülebilir bir malzemedir. Ayrıca kolayca işlenebilir ve dökülebilir. ⓘ
Alüminyum mükemmel bir termal ve elektriksel iletkendir, bakırın yoğunluğunun sadece %30'una sahipken bakırın hem termal hem de elektriksel iletkenliğinin yaklaşık %60'ına sahiptir. Alüminyum, 1,2 kelvinlik bir süper iletken kritik sıcaklık ve yaklaşık 100 gaussluk (10 militeslas) bir kritik manyetik alan ile süper iletkenlik yeteneğine sahiptir. Paramanyetiktir ve bu nedenle statik manyetik alanlardan esasen etkilenmez. Bununla birlikte, yüksek elektrik iletkenliği, girdap akımlarının indüksiyonu yoluyla alternatif manyetik alanlardan güçlü bir şekilde etkilendiği anlamına gelir. ⓘ
Kimya
Alüminyum, geçiş öncesi ve geçiş sonrası metallerin özelliklerini birleştirir. Daha ağır grup 13 konjenerleri gibi metalik bağ için az sayıda kullanılabilir elektrona sahip olduğundan, beklenenden daha uzun atomlar arası mesafelerle geçiş sonrası bir metalin karakteristik fiziksel özelliklerine sahiptir. Ayrıca, Al3+ küçük ve yüksek yüklü bir katyon olduğundan, güçlü bir şekilde polarize olur ve alüminyum bileşiklerinde bağlanma kovalentliğe doğru eğilim gösterir; bu davranış berilyum (Be2+) ile benzerdir ve ikisi diyagonal bir ilişki örneği sergiler. ⓘ
Alüminyumun değerlik kabuğunun altında yatan çekirdek bir önceki soy gazın çekirdeğidir, oysa daha ağır olan galyum, indiyum, talyum ve nihonyumunkiler de dolu bir d-alt kabuğu ve bazı durumlarda dolu bir f-alt kabuğu içerir. Bu nedenle, alüminyumun iç elektronları, alüminyumun daha ağır türdeşlerinin aksine, değerlik elektronlarını neredeyse tamamen korur. Bu nedenle, alüminyum kendi grubundaki en elektropozitif metaldir ve hidroksiti aslında galyumunkinden daha baziktir. Alüminyum aynı gruptaki metaloid bor ile de küçük benzerlikler taşır: AlX3 bileşikleri BX3 bileşiklerine göre değerlik izoelektroniktir (aynı değerlik elektronik yapısına sahiptirler) ve her ikisi de Lewis asitleri gibi davranır ve kolayca adüktler oluşturur. Ayrıca, bor kimyasının ana motiflerinden biri düzenli ikozahedral yapılardır ve alüminyum, Al-Zn-Mg sınıfı da dahil olmak üzere birçok ikozahedral kuasikristal alaşımın önemli bir parçasını oluşturur. ⓘ
Alüminyumun oksijene karşı yüksek bir kimyasal yakınlığı vardır, bu da onu termit reaksiyonunda indirgeyici bir madde olarak kullanıma uygun hale getirir. İnce bir alüminyum metal tozu sıvı oksijenle temas ettiğinde patlayıcı bir şekilde reaksiyona girer; ancak normal koşullar altında alüminyum, metali oksijen, su veya seyreltik asitle daha fazla korozyona karşı koruyan ince bir oksit tabakası (oda sıcaklığında ~5 nm) oluşturur, bu işleme pasivasyon denir. Korozyona karşı genel direnci nedeniyle alüminyum, ince toz halinde gümüşi yansımayı koruyan birkaç metalden biridir ve bu da onu gümüş renkli boyaların önemli bir bileşeni haline getirir. Alüminyum, pasifleştirici özelliği nedeniyle oksitleyici asitler tarafından saldırıya uğramaz. Bu, alüminyumun nitrik asit, konsantre sülfürik asit ve bazı organik asitler gibi reaktifleri depolamak için kullanılmasına izin verir. ⓘ
Sıcak konsantre hidroklorik asitte alüminyum, hidrojen çıkışı ile su ile reaksiyona girer ve oda sıcaklığında sulu sodyum hidroksit veya potasyum hidroksit içinde alüminatlar oluşturur - bu koşullar altında koruyucu pasivasyon ihmal edilebilir düzeydedir. Aqua regia da alüminyumu çözer. Alüminyum, yaygın sodyum klorür gibi çözünmüş klorürler tarafından aşındırılır, bu nedenle ev tesisatı asla alüminyumdan yapılmaz. Alüminyum üzerindeki oksit tabakası da amalgamasyon nedeniyle cıva ile veya bazı elektropozitif metallerin tuzları ile temas ettiğinde yok olur. Bu nedenle, en güçlü alüminyum alaşımları, alaşımlı bakır ile galvanik reaksiyonlar nedeniyle korozyona daha az dayanıklıdır ve alüminyumun korozyon direnci, özellikle farklı metallerin varlığında sulu tuzlar tarafından büyük ölçüde azaltılır. ⓘ
Alüminyum, ısıtıldığında çoğu ametal ile reaksiyona girerek alüminyum nitrür (AlN), alüminyum sülfür (Al2S3) ve alüminyum halojenürler (AlX3) gibi bileşikler oluşturur. Ayrıca periyodik tablodaki her gruptan metalleri içeren çok çeşitli metaller arası bileşikler oluşturur. ⓘ
İnorganik bileşikler
Tüm alüminyum içeren mineraller ve ticari olarak önemli tüm alüminyum bileşikleri dahil olmak üzere bileşiklerin büyük çoğunluğu 3+ oksidasyon durumunda alüminyum içerir. Bu tür bileşiklerin koordinasyon sayısı değişir, ancak genellikle Al3+ ya altı ya da dört koordinatlıdır. Neredeyse tüm alüminyum(III) bileşikleri renksizdir. ⓘ
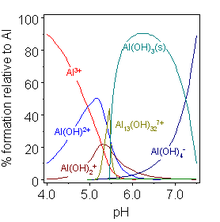
Sulu çözeltide Al3+, yaklaşık Ka değeri 10-5 olan hekzaku katyonu [Al(H2O)6]3+ olarak bulunur. Bu tür çözeltiler asidiktir çünkü bu katyon bir proton donörü olarak hareket edebilir ve alüminyum hidroksit, Al(OH)3, çökeltisi oluşana kadar aşamalı olarak hidrolize olabilir. Bu çökelti sudaki asılı partiküller üzerinde çekirdeklenerek onları uzaklaştırdığı için suyun arıtılmasında faydalıdır. pH'ın daha da artırılması, alüminat, [Al(H2O)2(OH)4]- oluşurken hidroksitin tekrar çözünmesine yol açar. ⓘ
Alüminyum hidroksit hem tuzlar hem de alüminatlar oluşturur ve asit ve alkali içinde ve ayrıca asidik ve bazik oksitlerle füzyonda çözünür. Al(OH)3'ün bu davranışı amfoterizm olarak adlandırılır ve çözünmeyen hidroksitler oluşturan ve hidratlı türleri de protonlarını bağışlayabilen zayıf bazik katyonların karakteristiğidir. Bunun bir etkisi, zayıf asitli alüminyum tuzlarının suda hidrolize olarak suda çözünmüş hidroksit ve karşılık gelen ametal hidrite dönüşmesidir: örneğin, alüminyum sülfür hidrojen sülfür verir. Bununla birlikte, alüminyum karbonat gibi bazı tuzlar sulu çözeltide bulunur, ancak bu şekilde kararsızdır; ve halojenürler, nitrat ve sülfat gibi güçlü asitlere sahip tuzlar için sadece eksik hidroliz gerçekleşir. Benzer nedenlerden dolayı, susuz alüminyum tuzları "hidratları" ısıtılarak yapılamaz: hidratlı alüminyum klorür aslında AlCl3-6H2O değil [Al(H2O)6]Cl3'tür ve Al-O bağları o kadar güçlüdür ki ısıtma bunları kırmak ve yerine Al-Cl bağları oluşturmak için yeterli değildir:
- 2[Al(H2O)6]Cl3 Al2O3 + 6 HCl + 9 H2O ⓘ
Dört trihalid de iyi bilinmektedir. Üç ağır trihalitin yapısından farklı olarak, alüminyum florür (AlF3) altı koordinatlı alüminyuma sahiptir, bu da tutarsızlığını ve çözünmezliğini ve ayrıca yüksek oluşum ısısını açıklar. Her bir alüminyum atomu, her bir flor atomunun iki oktahedranın köşeleri arasında paylaşıldığı çarpık bir oktahedral düzenlemede altı flor atomu ile çevrilidir. Bu tür {AlF6} birimleri kriyolit, Na3AlF6 gibi karmaşık florürlerde de bulunur. AlF3 1.290 °C'de (2.354 °F) erir ve alüminyum oksidin hidrojen florür gazı ile 700 °C'de (1.300 °F) reaksiyona girmesiyle elde edilir. ⓘ
Daha ağır halojenürlerde koordinasyon sayıları daha düşüktür. Diğer trihalidler, tetrahedral dört koordinatlı alüminyum merkezleri ile dimerik veya polimeriktir. Alüminyum triklorür (AlCl3) erime noktası olan 192,4 °C'nin (378 °F) altında katmanlı polimerik bir yapıya sahiptir ancak erime sırasında Al2Cl6 dimerlerine dönüşür. Daha yüksek sıcaklıklarda bunlar giderek BCl3 yapısına benzer trigonal düzlemsel AlCl3 monomerlerine ayrışır. Alüminyum tribromür ve alüminyum triiyodür her üç fazda da Al2X6 dimerleri oluşturur ve bu nedenle faz değişiminde bu kadar önemli özellik değişiklikleri göstermez. Bu malzemeler alüminyum metalinin halojen ile muamele edilmesiyle hazırlanır. Alüminyum trihalidler birçok ek bileşik veya kompleks oluşturur; Lewis asidik yapıları onları Friedel-Crafts reaksiyonları için katalizör olarak faydalı kılar. Alüminyum triklorür, antrakinon ve stiren üretiminde olduğu gibi bu reaksiyonu içeren önemli endüstriyel kullanımlara sahiptir; aynı zamanda diğer birçok alüminyum bileşiği için öncü olarak ve ametal florürleri karşılık gelen klorürlere dönüştürmek için bir reaktif olarak kullanılır (bir transhalojenasyon reaksiyonu). ⓘ
Alüminyum, genellikle alümina olarak adlandırılan Al2O3 kimyasal formülüne sahip kararlı bir oksit oluşturur. Doğada korundum, α-alümina mineralinde bulunabilir; ayrıca bir γ-alümina fazı da vardır. Kristal formu olan korindon çok serttir (Mohs sertliği 9), 2.045 °C (3.713 °F) gibi yüksek bir erime noktasına sahiptir, çok düşük uçuculuğa sahiptir, kimyasal olarak inerttir ve iyi bir elektrik yalıtkanıdır, genellikle aşındırıcılarda (diş macunu gibi), refrakter malzeme olarak ve seramiklerde kullanılır ve ayrıca alüminyum metalinin elektrolitik üretimi için başlangıç malzemesidir. Safir ve yakut, eser miktarda diğer metallerle kirlenmiş saf olmayan korindondur. İki ana oksit-hidroksit, AlO(OH), boehmit ve diaspordur. Üç ana trihidroksit vardır: kristal yapılarında (polimorflar) farklılık gösteren bayerit, gibsit ve nordstrandit. Diğer birçok ara ve ilgili yapı da bilinmektedir. Çoğu cevherden asit ve baz kullanılarak çeşitli ıslak işlemlerle üretilir. Hidroksitlerin ısıtılması korundum oluşumuna yol açar. Bu malzemeler alüminyum üretiminde merkezi öneme sahiptir ve kendileri de son derece kullanışlıdır. Spinel (MgAl2O4), Na-β-alümina (NaAl11O17) ve trikalsiyum alüminat (Ca3Al2O6, Portland çimentosunda önemli bir mineral faz) gibi bazı karışık oksit fazları da çok kullanışlıdır. ⓘ
Normal koşullar altında tek kararlı kalkojenitler alüminyum sülfit (Al2S3), selenit (Al2Se3) ve tellürittir (Al2Te3). Her üçü de elementlerinin yaklaşık 1.000 °C'de (1.800 °F) doğrudan reaksiyonu ile hazırlanır ve alüminyum hidroksit ve ilgili hidrojen kalkojenidi vermek için suda hızla tamamen hidrolize olur. Alüminyum bu kalkojenlere göre küçük bir atom olduğundan, bunlar dört koordinatlı tetrahedral alüminyuma sahiptir ve çeşitli polimorflar wurtzite ile ilgili yapılara sahiptir, olası metal bölgelerinin üçte ikisi düzenli (α) veya rastgele (β) bir şekilde işgal edilmiştir; sülfür ayrıca γ-alümina ile ilgili bir γ formuna ve alüminyum atomlarının yarısının tetrahedral dört koordinasyona ve diğer yarısının trigonal bipiramidal beş koordinasyona sahip olduğu alışılmadık bir yüksek sıcaklık altıgen formuna sahiptir. ⓘ
Dört pnictid - alüminyum nitrür (AlN), alüminyum fosfit (AlP), alüminyum arsenit (AlAs) ve alüminyum antimonit (AlSb) - bilinmektedir. Bunların hepsi III-V yarı iletkenler olup, silikon ve germanyumla izoelektroniktir ve AlN hariç hepsi çinko blende yapısına sahiptir. Dördü de bileşen elementlerinin yüksek sıcaklıkta (ve muhtemelen yüksek basınçta) doğrudan reaksiyonu ile yapılabilir. ⓘ
Alüminyum diğer metallerin çoğuyla (alkali metallerin çoğu ve grup 13 metalleri hariç) iyi alaşım oluşturur ve diğer metallerle 150'den fazla intermetalik bilinmektedir. Hazırlanması, sabit metallerin belirli oranlarda ısıtılmasını, ardından kademeli olarak soğutulmasını ve tavlanmasını içerir. İçlerindeki bağlar ağırlıklı olarak metaliktir ve kristal yapı öncelikle paketlenmenin verimliliğine bağlıdır. ⓘ
Daha düşük oksidasyon durumlarına sahip az sayıda bileşik vardır. Birkaç alüminyum (I) bileşiği mevcuttur: AlF, AlCl, AlBr ve AlI, ilgili trihalid alüminyum ile ısıtıldığında gaz fazında ve kriyojenik sıcaklıklarda bulunur. Alüminyum monoiyodürün kararlı bir türevi, trietilamin ile oluşan siklik eklentidir, Al4I4(NEt3)4. Al2O ve Al2S de mevcuttur ancak çok kararsızdır. Çok basit alüminyum(II) bileşikleri, Al metalinin oksidanlarla reaksiyonlarında ortaya çıkar veya gözlenir. Örneğin, alüminyum monoksit, AlO, patlamadan sonra gaz fazında ve yıldız absorpsiyon spektrumlarında tespit edilmiştir. Al-Al bağı içeren ve R'nin büyük bir organik ligand olduğu R4Al2 formüllü bileşikler daha kapsamlı bir şekilde araştırılmıştır. ⓘ
Organoalüminyum bileşikleri ve ilgili hidrürler
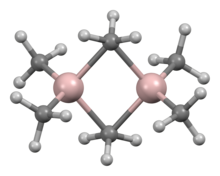
Ampirik formülü AlR3 ve AlR1.5Cl1.5 olan çeşitli bileşikler mevcuttur. Alüminyum trialkiller ve triariller reaktif, uçucu ve renksiz sıvılar veya düşük erime noktalı katılardır. Havada kendiliğinden alev alırlar ve su ile reaksiyona girerler, bu nedenle kullanımları sırasında önlem alınmasını gerektirir. Bor analoglarının aksine genellikle dimerler oluştururlar, ancak bu eğilim dallı zincirli alkiller (örneğin Pri, Bui, Me3CCH2) için azalır; örneğin, triizobütilalüminyum, monomer ve dimerin bir denge karışımı olarak bulunur. Trimetilalüminyum (Al2Me6) gibi bu dimerler, genellikle her iki alüminyum atomu arasında köprü oluşturan bir alkil grubu ile dimerizasyon sonucu oluşan dört yüzlü Al merkezlerine sahiptir. Sert asitlerdir ve ligandlarla kolayca reaksiyona girerek adüktler oluştururlar. Endüstride çoğunlukla Karl Ziegler tarafından keşfedilen alken ekleme reaksiyonlarında, en önemlisi uzun zincirli dallanmamış birincil alkenler ve alkoller oluşturan "büyüme reaksiyonlarında" ve eten ve propenin düşük basınçlı polimerizasyonunda kullanılırlar. Al-N bağlarını içeren bazı heterosiklik ve küme organoalüminyum bileşikleri de vardır. ⓘ
Endüstriyel olarak en önemli alüminyum hidrür, organik kimyada indirgeyici madde olarak kullanılan lityum alüminyum hidrürdür (LiAlH4). Lityum hidrür ve alüminyum triklorürden üretilebilir. En basit hidrür olan alüminyum hidrür veya alane o kadar önemli değildir. (BH3)2 formülüne sahip bir dimer olan karşılık gelen bor hidrürün aksine, (AlH3)n formülüne sahip bir polimerdir. ⓘ
Doğal oluşum
Ayrıca bkz. Boksit üretimine göre ülkelerin listesi ⓘ
Uzay
Alüminyumun Güneş Sistemi'ndeki parçacık başına bolluğu 3,15 ppm'dir (milyonda bir parça). Tüm elementler arasında en bol bulunan on ikinci, tek atom numarasına sahip elementler arasında ise hidrojen ve nitrojenden sonra en bol bulunan üçüncü elementtir. Alüminyumun tek kararlı izotopu olan 27Al, Evren'de en çok bulunan on sekizinci çekirdektir. Neredeyse tamamen, daha sonra Tip II süpernovalara dönüşecek olan büyük yıldızlardaki karbon füzyonundan sonra oluşur: bu füzyon, serbest proton ve nötronları yakaladıktan sonra alüminyuma dönüşen 26Mg'yi yaratır. Bazı küçük miktarlarda 27Al, 26Mg'nin serbest protonları yakalayabildiği evrimleşmiş yıldızların hidrojen yakan kabuklarında yaratılır. Esasen şu anda var olan tüm alüminyum 27Al'dir. 26Al, 27Al'e göre %0,005'lik bir bollukla erken Güneş Sistemi'nde mevcuttu, ancak 728.000 yıllık yarı ömrü herhangi bir orijinal çekirdeğin hayatta kalması için çok kısadır; 26Al bu nedenle yok olmuştur. 27Al'in aksine, 26Al'in birincil kaynağı hidrojen yanmasıdır ve nüklit, 25Mg çekirdeğinin serbest bir protonu yakalamasının ardından ortaya çıkar. Bununla birlikte, var olan eser miktardaki 26Al, yıldızlararası gazdaki en yaygın gama ışını yayıcıdır; eğer orijinal 26Al hala mevcut olsaydı, Samanyolu'nun gama ışını haritaları daha parlak olurdu. ⓘ
Dünya

Genel olarak, Dünya kütlece yaklaşık %1.59 alüminyumdur (kütlece yedinci sıradadır). Alüminyum, Evren'in geneline kıyasla Dünya'nın kabuğunda daha büyük oranda vardır çünkü alüminyum kolayca oksitlenir ve kayalara bağlanıp kalır. Dünya'nın kabuğu'nda daha az reaktif metaller çekirdeğe doğru batar. Yerkabuğunda alüminyum en bol bulunan metalik elementtir (kütlece %8.23) ve tüm elementler arasında en bol bulunan üçüncü elementtir. (oksijen ve silikondan sonra). Yerkabuğundaki çok sayıda silikat alüminyum içerir. Buna karşılık, Dünya'nın manto kütlesinin sadece %2.38'i alüminyumdur. Alüminyum ayrıca deniz suyunda 2 μg/kg konsantrasyonda bulunur. ⓘ
Oksijene olan güçlü birleşme eğilimi (ing: affinity) nedeniyle, alüminyum element halinde neredeyse hiç bulunmaz; bunun yerine oksitlerde veya silikatlarda bulunur. Feldspatlar, yerkabuğundaki en yaygın mineral grubu, alüminosilikatlardır. Alüminyum ayrıca beril, kriyolit, garnet, spinel ve turkuaz minerallerinde de bulunur. Al2O3 içindeki krom ve demir gibi safsızlıklar, sırasıyla yakut ve safir gibi değerli taş ürünlerini verir. Doğal alüminyum metali son derece nadirdir ve yalnızca belirli volkanların iç kısımları gibi düşük oksijenli fugasite ortamlarda küçük bir faz olarak bulunabilir. Güney Çin Denizi'nin kuzeydoğusunda kıtasal eğimdeki soğuk sızıntılarda doğal alüminyum bildirilmiştir. Bu tortuların, tetrahidroksoalüminat Al(OH)4−'un bakteriyel redüksiyonundan kaynaklanmış olması mümkündür. ⓘ
Alüminyum bol bir element olmasına rağmen, tüm alüminyum mineralleri ekonomik olarak uygun metal kaynakları değildir. Hemen hemen tüm metalik alüminyum, cevher boksit (AlOx(OH)3–2x)'dan üretilir. Boksit, tropikal iklim koşullarında düşük demir ve silika anakayasının kötü havadan ayrışma ürünü olarak oluşur. 2017 yılında çoğu boksit Avustralya, Çin, Gine ve Hindistan'da çıkarıldı. ⓘ
Yerkabuğunda çok nadir bulunduğundan alüminyum bir zamanlar altından bile daha kıymetli görülmüştür. ⓘ
Tarih

Alüminyumun tarihi şap kullanımı ile şekillenmiştir. Yunan tarihçi Herodot tarafından yapılan ilk yazılı kayıt M.Ö. 5. yüzyıla kadar uzanmaktadır. Eskilerin şapı boya mordanı olarak ve şehir savunmasında kullandıkları bilinmektedir. Haçlı Seferleri'nden sonra Avrupa kumaş endüstrisinde vazgeçilmez bir mal olan şap, uluslararası ticarete konu olmuş; 15. yüzyılın ortalarına kadar Doğu Akdeniz'den Avrupa'ya ithal edilmiştir. ⓘ
Şapın doğası bilinmiyordu. Yaklaşık 1530 yılında İsviçreli doktor Paracelsus, şapın bir toprak tuzu olduğunu öne sürdü. 1595 yılında Alman doktor ve kimyager Andreas Libavius bunu deneysel olarak doğruladı. 1722'de Alman kimyager Friedrich Hoffmann, şapın bazının ayrı bir toprak olduğuna inandığını açıkladı. 1754 yılında Alman kimyager Andreas Sigismund Marggraf, kili sülfürik asitte kaynatarak ve ardından potas ekleyerek alüminayı sentezlemiştir. ⓘ
Alüminyum metali üretme girişimleri 1760 yılına kadar uzanmaktadır. Ancak ilk başarılı girişim 1824 yılında Danimarkalı fizikçi ve kimyager Hans Christian Ørsted tarafından gerçekleştirilmiştir. Susuz alüminyum klorürü potasyum amalgam ile reaksiyona sokarak kalaya benzeyen bir metal topağı elde etti. Sonuçlarını sundu ve 1825 yılında yeni metalin bir örneğini gösterdi. 1827'de Alman kimyager Friedrich Wöhler, Ørsted'in deneylerini tekrarladı ancak herhangi bir alüminyum tespit edemedi. (Bu tutarsızlığın nedeni ancak 1921 yılında keşfedilmiştir.) Aynı yıl susuz alüminyum klorürü potasyumla karıştırarak benzer bir deney yapmış ve bir alüminyum tozu üretmiştir. 1845 yılında metalden küçük parçalar üretmeyi başardı ve bu metalin bazı fiziksel özelliklerini tanımladı. Wöhler bundan sonra uzun yıllar boyunca alüminyumun kaşifi olarak anıldı. ⓘ

Wöhler'in yöntemi büyük miktarlarda alüminyum üretemediği için metal nadir kaldı; maliyeti altınınkini aştı. Alüminyumun ilk endüstriyel üretimi 1856 yılında Fransız kimyager Henri Etienne Sainte-Claire Deville ve arkadaşları tarafından gerçekleştirilmiştir. Deville, alüminyum triklorürün, Wöhler'in kullandığı potasyumdan daha uygun ve daha ucuz olan sodyum ile indirgenebileceğini keşfetmişti. O zaman bile alüminyum hala çok saf değildi ve üretilen alüminyumun özellikleri numuneye göre farklılık gösteriyordu. Elektrik iletme kapasitesi nedeniyle alüminyum, 1885 yılında tamamlanan Washington Anıtı'nın kapağı olarak kullanıldı. O dönemde dünyanın en yüksek binası olan bu aşınmayan metal başlığın bir paratoner tepesi olarak hizmet vermesi amaçlanmıştı. ⓘ
İlk endüstriyel büyük ölçekli üretim yöntemi 1886 yılında Fransız mühendis Paul Héroult ve Amerikalı mühendis Charles Martin Hall tarafından bağımsız olarak geliştirildi; günümüzde Hall-Héroult süreci olarak bilinmektedir. Hall-Héroult prosesi alüminayı metale dönüştürür. Avusturyalı kimyager Carl Joseph Bayer 1889 yılında boksitin saflaştırılarak alümina elde edilmesini sağlayan ve günümüzde Bayer prosesi olarak bilinen yöntemi keşfetmiştir. Alüminyum metalinin modern üretimi Bayer ve Hall-Héroult süreçlerine dayanmaktadır. ⓘ
Alüminyum fiyatları düştü ve alüminyum 1890'larda ve 20. yüzyılın başlarında mücevherlerde, günlük eşyalarda, gözlük çerçevelerinde, optik aletlerde, sofra takımlarında ve folyoda yaygın olarak kullanılmaya başlandı. Alüminyumun diğer metallerle sert ama hafif alaşımlar oluşturma yeteneği, metalin o dönemde birçok kullanım alanı bulmasını sağlamıştır. Birinci Dünya Savaşı sırasında, büyük hükümetler hafif ve güçlü uçak gövdeleri için büyük miktarlarda alüminyum sevkiyatı talep etti; İkinci Dünya Savaşı sırasında, büyük hükümetlerin havacılık için talebi daha da yüksekti. ⓘ
20. yüzyılın ortalarına gelindiğinde alüminyum günlük yaşamın bir parçası ve ev eşyalarının temel bir bileşeni haline gelmişti. 1954 yılında alüminyum üretimi, tarihsel olarak üretimde demirden sonra ikinci sırada yer alan bakır üretimini geçerek en çok üretilen demir dışı metal haline geldi. 20. yüzyılın ortalarında alüminyum, hem temel inşaat hem de iç kaplama işlerinde bina uygulamaları ile bir inşaat mühendisliği malzemesi olarak ortaya çıktı ve hem uçaklar hem de kara zırhlı araç motorları için askeri mühendislikte giderek daha fazla kullanılmaya başlandı. Dünya'nın 1957 yılında fırlatılan ilk yapay uydusu, birleştirilmiş iki ayrı alüminyum yarı küreden oluşuyordu ve sonraki tüm uzay araçları bir dereceye kadar alüminyum kullandı. Alüminyum kutu 1956 yılında icat edilmiş ve 1958 yılında içecek deposu olarak kullanılmaya başlanmıştır. ⓘ

20. yüzyıl boyunca alüminyum üretimi hızla artmıştır: 1900 yılında dünya alüminyum üretimi 6.800 metrik ton iken, yıllık üretim ilk olarak 1916 yılında 100.000 metrik tonu aşmıştır; 1941 yılında 1.000.000 ton; 1971 yılında 10.000.000 ton. 1970'lerde alüminyuma olan talebin artması onu bir borsa malı haline getirdi; 1978'de dünyanın en eski endüstriyel metal borsası olan Londra Metal Borsası'na girdi. Üretim artmaya devam etti: 2013 yılında yıllık alüminyum üretimi 50.000.000 metrik tonu aştı. ⓘ
Alüminyumun reel fiyatı 1900 yılında metrik ton başına 14.000 $ iken 1948 yılında 2.340 $'a (1998 ABD doları cinsinden) düşmüştür. Çıkarma ve işleme maliyetleri teknolojik ilerleme ve ekonomilerin ölçeği sayesinde düşürülmüştür. Ancak, daha düĢük kaliteli yatakların iĢletilmesi ihtiyacı ve hızla artan girdi maliyetleri (özellikle enerji) alüminyumun net maliyetini artırmıĢtır. 1970 "lerde enerji maliyetinin yükselmesiyle gerçek fiyat artmaya baĢlamıĢtır. Üretim, sanayileşmiş ülkelerden üretimin daha ucuz olduğu ülkelere kaymıştır. Üretim maliyetleri 20. yüzyılın sonlarında teknolojideki ilerlemeler, düşük enerji fiyatları, ABD doları döviz kurları ve alümina fiyatları nedeniyle değişmiştir. BRIC ülkelerinin birincil üretim ve birincil tüketimdeki toplam payı 21. yüzyılın ilk on yılında önemli ölçüde artmıştır. Çin, kaynak bolluğu, ucuz enerji ve hükümet teşvikleri sayesinde dünya üretiminden özellikle büyük bir pay almaktadır; ayrıca 1972'de %2 olan tüketim payını 2010'da %40'a çıkarmıştır. Amerika Birleşik Devletleri, Batı Avrupa ve Japonya'da alüminyumun çoğu ulaşım, mühendislik, inşaat ve ambalajlama alanlarında tüketilmiştir. 2021 yılında, Çin'deki enerji kıtlığının elektrik maliyetlerini artırması nedeniyle alüminyum gibi endüstriyel metallerin fiyatları neredeyse rekor seviyelere yükseldi. ⓘ
Eski Yunanlar ve Romalılar, alüminyum(æljʊˈmɪniəm)un tuzlarını, boyaların renklerini sabitleştirmede ve kan durdurucu olarak kullanmışlardır. Alum günümüz tıbbında hala kan durdurucu ve damar büzücü olarak kullanılmaktadır. ⓘ
Amerikalı Charles Martin Hall 1886'da, alüminyumun elektrolitik bir işlemle eldesine ilişkin bir patent başvurusunda (patent no: 400655) bulunmuş, aynı yıl, Hall'un bu buluşundan tamamen habersiz olmak üzere Fransız Paul Héroult da aynı tekniği Avrupa'da geliştirmiştir. Bu nedenle iki bilim adamının adı verilen Hall-Heroult işlemi, günümüzde alüminyumun cevherinden eldesinde bütün dünyada kullanılan temel yöntemdir. ⓘ
ABD'deki Washington anıtının zirvesinin yapımında alüminyum kullanılması kararlaştırılmış ve o tarihte alüminyumun yaklaşık 30 gramının maliyeti bu projede çalışan bir işçinin yevmiyesinin iki katına eşdeğer olmuştur. ⓘ
Adolf Hitler'in yönetime gelişinden hemen sonraki yıllarda Almanya, alüminyum üretiminde dünya lideri olmuştur. Ancak 1942'de, ABD'de yeni hidroelektrik santral projelerinin (örneğin, Grand Coulee Barajı) devreye alınması, ABD'ye Nazi Almanya'sının başedemeyeceği bir üstünlük vermiştir. Bu üstünlük, dört yıl içinde 60 bin savaş uçağı yapmaya yetecek kadar alüminyum üretimi şeklinde ortaya çıkmıştır. ⓘ
Etimoloji
Alüminyum ve alüminyum isimleri, doğal olarak oluşan bir alüminyum oksit olan alümina için kullanılan eski bir terim olan alümin kelimesinden türetilmiştir. Alumine Fransızca'dan ödünç alınmış, o da alumen'den, yani toplandığı mineral olan şapın klasik Latince adından türetmiştir. Latince alumen kelimesi, "acı" veya "bira" anlamına gelen Proto-Hint-Avrupa kökü *alu-'dan gelmektedir. ⓘ

Madeni Para
Metali izole etmeyi amaçlayan bir dizi deney gerçekleştiren İngiliz kimyager Humphry Davy, elementi adlandıran kişi olarak anılır. Şaptan izole edilecek metal için önerilen ilk isim, Davy'nin elektrokimyasal araştırmaları üzerine 1808 yılında Philosophical Transactions of the Royal Society'de yayınlanan bir makalesinde önerdiği alumium'dur. Bu ismin İngilizce alum kelimesinden ve Latince -ium son ekinden türetildiği anlaşılıyordu; ancak o zamanlar elementlere Latince kökenli isimler vermek alışılmış bir durumdu, dolayısıyla bu isim evrensel olarak benimsenmedi. Bu isim Fransa, Almanya ve İsveç'ten çağdaş kimyagerler tarafından eleştirilmiş ve metalin, izole edileceği oksit olan alümina ile adlandırılması gerektiğinde ısrar etmişlerdir. İngilizce alum ismi doğrudan Latince'den gelmemektedir, oysa alumine/alumina açıkça Latince alumen kelimesinden gelmektedir (çekime uğradığında alumen alumin- olarak değişir). ⓘ
Bir örnek, İsveçli bir kimyager olan Jöns Jacob Berzelius tarafından Fransızca olarak yazılan Essai sur la Nomenclature chimique (Temmuz 1811) adlı makaledir ve burada şaptan sentezlenecek elemente alüminyum adı verilmiştir. (Aynı dergi sayısında yer alan bir başka makalede de safirin temelini oluşturan oksit metale alüminyum adı verilmiştir). Ocak 1811'de Davy'nin Royal Society'de verdiği derslerden birinin özetinde alüminyum adı bir olasılık olarak belirtilmiştir. Ertesi yıl Davy, alüminyum yazımını kullandığı bir kimya ders kitabı yayınladı. O zamandan beri her iki yazım da bir arada var olmuştur. Kullanımları bölgeseldir: Amerika Birleşik Devletleri ve Kanada'da alüminyum baskındır; İngilizce konuşulan dünyanın geri kalanında alüminyum. ⓘ
Yazım
1812'de İngiliz bilim adamı Thomas Young, Davy'nin kitabına anonim bir eleştiri yazarak alüminyum yerine "daha az klasik bir sese" sahip olduğunu düşündüğü aluminium ismini önerdi. Bu isim tuttu: İngiltere'de zaman zaman -um yazımı kullanılsa da, Amerikan bilim dili en başından beri -ium'u kullandı. Dünyadaki çoğu bilim insanı 19. yüzyılda -ium'u kullandı; ve Fransızca, Almanca ve Hollandaca gibi diğer birçok Avrupa diline yerleşti. 1828'de Amerikalı sözlükbilimci Noah Webster, Amerikan İngiliz Dili Sözlüğü'ne yalnızca alüminyum yazımını girmiştir. 1830'larda -um yazımı Amerika Birleşik Devletleri'nde kullanılmaya başlandı; 1860'lara gelindiğinde ise bilim dışında en yaygın yazım haline geldi. 1892 yılında Hall, 1886 ile 1903 yılları arasında aldığı tüm patentlerde sürekli olarak -ium yazımını kullanmasına rağmen, metali üretmek için geliştirdiği yeni elektrolitik yöntemin reklam broşüründe -um yazımını kullanmıştır: bu yazımın yanlışlıkla mı yoksa kasıtlı olarak mı kullanıldığı bilinmemektedir; ancak Hall, prestijli bir metalin adı olan platine benzediği için alüminyum yazımını tercih etmiştir. 1890'da Amerika Birleşik Devletleri'nde her iki yazım da yaygındı, -ium yazımı biraz daha yaygındı; 1895'te durum tersine döndü; 1900'de alüminyum, aluminyumdan iki kat daha yaygın hale geldi; sonraki on yılda -um yazımı Amerikan kullanımına hakim oldu. 1925 yılında Amerikan Kimya Derneği bu yazımı benimsemiştir. ⓘ
Uluslararası Saf ve Uygulamalı Kimya Birliği (IUPAC) 1990 yılında alüminyumu element için standart uluslararası isim olarak kabul etti. 1993'te, alüminyumu kabul edilebilir bir varyant olarak tanıdılar; IUPAC inorganik kimya terminolojisinin en son 2005 baskısı da bu yazımı kabul etmektedir. IUPAC resmi yayınları -ium yazımını birincil olarak kullanır ve uygun olduğu yerlerde her ikisini de listeler. ⓘ
İngilizce konuşulan ülkelerde, adının hem aluminium hem de aluminum şeklinde yazılması ve uygun tarzda okunması yaygındır. ABD'de aluminium pek bilinmemekte ve daha çok aluminum kullanılmaktadır. ABD'nin dışındaki diğer ülkelerde ise durum tam tersine olup aluminium şeklinde yazılış tarzı daha iyi bilinmektedir. Ancak Kanada'da her iki yazılış tarzı da yaygındır. ⓘ
İngilizcenin hakimiyeti dışındaki ülkelerde ise "ium" şeklindeki yazılış daha yaygındır. Hem Almanca hem de Fransızcada sözcük aluminium şeklindedir. ⓘ
Üretim ve arıtma

Ayrıca bkz. Birincil alüminyum üretimine göre ülkelerin listesi ⓘ
Alüminyumun ticari üretim tarihi 100 yıldan biraz fazladır. ⓘ
Alüminyum ilk keşfedildiği yıllarda cevherinden ayrıştırılması çok zor olan bir metal idi. Alüminyum arıtılmadı en zor metallerden biridir. Bunun nedeni çok hızlı oksitlenmesi, oluşan bu oksit tabakasının çok kararlı oluşu ve demirdeki pasın aksine yüzeyden sıyrılmayışıdır. ⓘ
Alüminyum üretimi çok enerji tüketir ve bu yüzden üreticiler izabe tesislerini elektriğin hem bol hem de ucuz olduğu yerlere yerleştirir. 2019 itibarıyla dünyanın en büyük alüminyum izabecileri, Çin, Hindistan, Rusya, Kanada ve Birleşik Arap Emirlikleri'nde bulunurken, Çin, yüzde elli beş dünya alüminyum payı ile açık ara en büyük alüminyum üreticisidir. ⓘ
Uluslararası Kaynak Paneli'nin Toplumdaki Metal Stokları raporu'na göre (ingilizce:Metal Stocks in Society report), toplumda (yani arabalarda, binalarda, elektronikte vb.) kullanılan küresel kişi başına alüminyum stoğu 80 kg (180 lb)'dır: Bunun çoğu, (sadece35 kg (77 lb)) 'nı kullanan daha az gelişmiş ülkeler yerine (kişi başına 350-500 kg (770-1.100 lb)) kullanım ile) daha gelişmiş ülkelerdedir. ⓘ
Alüminyum oksitin ergime sıcaklığı yaklaşık 2000 °C olduğundan ekonomik olmaktan uzaktır. ⓘ
Alüminyum üretimi, boksit kayanın yerden çıkarılmasıyla başlar. Boksit, Bayer işlemi kullanılarak işlenir ve alümina'ya dönüştürülür, daha sonra Hall–Héroult işlemi kullanılarak işlenir ve nihai alüminyum metali elde edilir. ⓘ
Bayer süreci
Boksit, Bayer prosesi ile alüminaya dönüştürülür. Boksit homojen bir bileşim için karıştırılır ve ardından öğütülür. Elde edilen bulamaç sıcak bir sodyum hidroksit çözeltisi ile karıştırılır; karışım daha sonra atmosferik basıncın çok üzerinde bir basınçta bir sindirici kapta işlenir, boksit içindeki alüminyum hidroksit çözünürken safsızlıklar nispeten çözünmeyen bileşiklere dönüştürülür:
Bu reaksiyondan sonra, bulamaç atmosferik kaynama noktasının üzerinde bir sıcaklıktadır. Basınç düşürülürken buhar çıkarılarak soğutulur. Boksit kalıntısı çözeltiden ayrılır ve atılır. Katı madde içermeyen çözelti küçük alüminyum hidroksit kristalleri ile tohumlanır; bu [Al(OH)4]- iyonlarının alüminyum hidroksite ayrışmasına neden olur. Alüminyumun yaklaşık yarısı çöktükten sonra karışım sınıflandırıcılara gönderilir. Küçük alüminyum hidroksit kristalleri tohumlama maddesi olarak kullanılmak üzere toplanır; kaba parçacıklar ısıtılarak alüminaya dönüştürülür; fazla çözelti buharlaştırma yoluyla uzaklaştırılır, (gerekirse) saflaştırılır ve geri dönüştürülür. ⓘ
Hall-Héroult prosesi

Ayrıca bakınız: Alüminyum oksit üreten ülkelerin listesi ⓘ
Alümina'nın alüminyum metale dönüştürülmesi Hall–Héroult işlemiyle sağlanır. Bu enerji yoğun süreçte, kriyolit (Na3AlF6) ile kalsiyum florür (950 ve 980 °C (1.740 ve 1.800 °F)'de erimiş karışımdaki alümina çözeltisi metalik alüminyum üretmek için elektroliz edilir. Sıvı alüminyum metal çözeltinin dibine çöker ve akıtılır ve daha sonraki işlemler için genellikle alüminyum kütükler (ingilizce: billet) adı verilen büyük bloklara dökülür. ⓘ
Elektroliz hücresinin anotları, florür korozyonuna karşı en dirençli malzeme olan karbondan yapılmıştır veya işlem sırasında pişirilir ya da önceden fırınlanır.Söderberg anotları olarak da adlandırılan birincisi güç açısından daha az verimlidir ve pişirmede açığa çıkan dumanların toplanması maliyetlidir, bu nedenle katotları önceden pişirmek için güç, enerji ve işçilikten tasarruf edilmesine rağmen, önceden pişirilmiş anotlarla değiştirilmelerinin nedeni budur. Anotlar için karbon tercihen saf olmalıdır, böylece ne alüminyum ne de elektrolit kül ile kirlenmez. Karbonun korozyona karşı direncine rağmen, üretilen her bir kilogram alüminyum için hala 0.4–0.5 kg oranında tüketilir. ⓘ
Katotlar antrasit'den yapılmıştır, çok saf olmaları gereksizdir çünkü safsızlıkların süzülmesi çok yavaştır. Katot, üretilen her kilogram alüminyum için 0.02-0.04 kg oranında tüketilir. Bir hücre genellikle katodun arızalanmasının ardından 2-6 yıl sonra sonlandırılır. ⓘ
Hall-Heroult işlemi, saflığı %99'un üzerinde olan alüminyum üretir. Hoopes işlemi ile daha fazla saflaştırma yapılabilir. Bu işlem, erimiş alüminyumun sodyum, baryum ve alüminyum florür elektroliti ile elektrolizini içerir. Elde edilen alüminyumun saflığı %99.99'dur. ⓘ
Elektrik gücü, izabe tesisinin konumuna bağlı olarak, alüminyum üretim maliyetinin yaklaşık %20 ila %40'ını temsil eder. Alüminyum üretimi, Amerika Birleşik Devletleri'nde üretilen elektriğin kabaca %5'ini tüketir. Bu nedenle, Hall-Héroult sürecine alternatifler araştırıldı ancak hiçbirinin ekonomik olarak uygulanabilir olmadığı ortaya çıktı. ⓘ
Alüminyum üretim maliyetinin %20-40'ını, tesisin bulunduğu yere göre değişmek üzere, elektrik enerjisi oluşturmaktadır. Bu nedenle alüminyum üreticisi işletmeler, Güney Afrika, Yeni Zelanda'nın Güney Adası, Avustralya, Çin, Orta Doğu, Rusya, İzlanda, Kanada'da Québec gibi elektrik enerjisinin bol ve ucuz olduğu bölgelere yakın olmak eğilimindedirler. ⓘ
Çin 2004 itibarıyla, alüminyum üretiminde dünya lideridir. ⓘ
Geri dönüşüm

Geri kazanım işlemi 1900'lü yılların başlarından beri uygulanmakta olup yeni değildir. Metalin geri dönüşüm yoluyla geri kazanılması, alüminyum endüstrisinin önemli bir görevi haline geldi. Geri dönüşüm, 1960'ların sonlarına kadar, alüminyum içecek kutuları kullanımının artmasıyla kamuoyunun bilinçlendirilmesine kadar önemsiz bir faaliyetti. Diğer geri döndürülen alüminyum kaynakları arasında otomobil parçaları, pencere ve kapılar, cihazlar ve konteynerler sayılabilir. ⓘ
Alüminyumun hurdalardan geri kazanımı, günümüz alüminyum endüstrisinin önemli bir bileşeni haline gelmiştir. ⓘ
Geri kazanım, girdi malzemesinin %15'ine kadar önemli bir kısmını cüruf, (kül benzeri oksit) olarak kaybolmasına rağmen, cevherden alüminyum üretmek için kullanılan enerjinin yalnızca %5'ini gerektiren hurdanın eritilmesini kapsar. Bir alüminyum yığın eritici, %1'in altında bildirilen değerlerle çok daha az cüruf üretir. ⓘ
Birincil alüminyum üretiminden ve ikincil geri dönüşüm işlemlerinden kaynaklanan beyaz cüruf, endüstriyel olarak çıkarılmış olabilecek yararlı miktarlarda alüminyum içerir. İşlem, son derece karmaşık atık malzeme ile birlikte alüminyum kütükler üretir. Bu israfın yönetimi zordur. Su ile reaksiyona girerek hava ile temas ettiğinde kendiliğinden tutuşan bir gaz karışımı (diğerlerinin yanı sıra hidrojen, asetilen ve amonyak dahil) açığa çıkarır; nemli hava ile temas çok miktarda amonyak gazının salınmasına neden olur. Bu zorluklara rağmen, atık asfalt ve beton'da dolgu maddesi olarak kullanılır. ⓘ
Uygulamalar

Metal
Küresel alüminyum üretimi 2016 yılında 58,8 milyon metrik ton olarak gerçekleşmiştir. Bu rakam demir hariç (1,231 milyon metrik ton) diğer tüm metallerin üretimini aşmıştır. ⓘ
Alüminyum neredeyse her zaman alaşımlıdır, bu da özellikle temperlendiğinde mekanik özelliklerini önemli ölçüde geliştirir. Örneğin, yaygın olarak kullanılan alüminyum folyolar ve içecek kutuları %92 ila %99 alüminyumdan oluşan alaşımlardır. Ana alaşım maddeleri bakır, çinko, magnezyum, manganez ve silikondur (örneğin duralumin) ve diğer metallerin seviyeleri ağırlıkça yüzde birkaçtır. Hem işlenmiş hem de dökülmüş alüminyum, diğerlerinin yanı sıra manganez, silikon, magnezyum, bakır ve çinko ile alaşımlandırılmıştır. Örneğin, Kynal alaşım ailesi İngiliz kimya üreticisi Imperial Chemical Industries tarafından geliştirilmiştir. ⓘ

Alüminyum metalinin başlıca kullanım alanları şunlardır:
- Ulaşım (otomobiller, uçaklar, kamyonlar, demiryolu araçları, deniz araçları, bisikletler, uzay araçları, vb.) Alüminyum düşük yoğunluğu nedeniyle kullanılır;
- Ambalajlama (teneke kutular, folyo, çerçeve, vb.). Alüminyum, toksik olmadığı (aşağıya bakınız), emici olmadığı ve kıymık geçirmez olduğu için kullanılır;
- Bina ve inşaat (pencereler, kapılar, dış cephe kaplamaları, bina teli, mantolama, çatı kaplama, vb.) Çelik daha ucuz olduğu için hafiflik, korozyon direnci veya mühendislik özellikleri önemli olduğunda alüminyum kullanılır;
- Elektrikle ilgili kullanımlar (iletken alaşımları, motorlar ve jeneratörler, transformatörler, kapasitörler, vb.) Alüminyum nispeten ucuz, yüksek iletken, yeterli mekanik mukavemete ve düşük yoğunluğa sahip olduğu ve korozyona dirençli olduğu için kullanılır;
- Pişirme gereçlerinden mobilyalara kadar çok çeşitli ev eşyaları. Düşük yoğunluk, iyi görünüm, imalat kolaylığı ve dayanıklılık alüminyum kullanımının temel faktörleridir;
- Makine ve ekipmanlar (işleme ekipmanları, borular, aletler). Alüminyum, korozyon direnci, piroforik olmaması ve mekanik mukavemeti nedeniyle kullanılır.
- Taşınabilir bilgisayar kasaları. Şu anda alaşımsız olarak nadiren kullanılmaktadır, ancak alüminyum geri dönüştürülebilir ve temiz alüminyumun artık piyasa değeri vardır: örneğin, kullanılmış içecek kutusu (UBC) malzemesi MacBook Air dizüstü bilgisayarın, Pixel 5 akıllı telefonun veya Summit Lite akıllı saatin elektronik bileşenlerini kaplamak için kullanılmıştır. ⓘ
Bileşikler
Alüminyum oksidin büyük çoğunluğu (yaklaşık %90) metalik alüminyuma dönüştürülür. Çok sert bir malzeme olan (Mohs sertliği 9) alümina, aşındırıcı olarak yaygın bir şekilde kullanılır; kimyasal olarak olağanüstü derecede inert olduğundan, yüksek basınçlı sodyum lambaları gibi oldukça reaktif ortamlarda kullanışlıdır. Alüminyum oksit yaygın olarak endüstriyel proseslerde katalizör olarak kullanılır; örneğin rafinerilerde hidrojen sülfürü sülfüre dönüştürmek ve aminleri alkillemek için Claus prosesi. Birçok endüstriyel katalizör alümina tarafından desteklenir, yani pahalı katalizör malzemesi inert alümina yüzeyi üzerinde dağılır. Bir diğer temel kullanım alanı ise kurutma maddesi veya emicidir. ⓘ

Alüminyumun çeşitli sülfatları endüstriyel ve ticari uygulamalara sahiptir. Alüminyum sülfat (hidrat formunda) yıllık birkaç milyon metrik ton ölçeğinde üretilmektedir. Yaklaşık üçte ikisi su arıtımında tüketilmektedir. Bir sonraki büyük uygulama kağıt üretimidir. Ayrıca boyamada mordan olarak, tohumların asitlenmesinde, mineral yağların kokusunun giderilmesinde, derinin tabaklanmasında ve diğer alüminyum bileşiklerinin üretiminde kullanılır. İki tür şap, amonyum şap ve potasyum şap, eskiden mordan olarak ve deri tabaklamada kullanılıyordu, ancak yüksek saflıkta alüminyum sülfatın bulunmasının ardından kullanımları önemli ölçüde azaldı. Susuz alüminyum klorür, kimya ve petrokimya endüstrilerinde, boyama endüstrisinde ve çeşitli inorganik ve organik bileşiklerin sentezinde katalizör olarak kullanılır. Alüminyum hidroksiklorürler suyun arıtılmasında, kağıt endüstrisinde ve ter önleyici olarak kullanılır. Sodyum alüminat suyun arıtılmasında ve çimentonun katılaşmasını hızlandırıcı olarak kullanılır. ⓘ
Birçok alüminyum bileşiğinin niş uygulamaları vardır, örneğin:
- Çözeltideki alüminyum asetat büzücü olarak kullanılır.
- Alüminyum fosfat cam, seramik, kağıt hamuru ve kağıt ürünleri, kozmetik, boya, vernik üretiminde ve diş çimentosunda kullanılır.
- Alüminyum hidroksit, antiasit ve mordan olarak kullanılır; ayrıca su arıtmada, cam ve seramik üretiminde ve kumaşların su geçirmezliğinde kullanılır.
- Lityum alüminyum hidrit organik kimyada kullanılan güçlü bir indirgeyici maddedir.
- Organoalüminyumlar Lewis asitleri ve yardımcı katalizörler olarak kullanılır.
- Metilalüminoksan, polieten gibi vinil polimerleri üretmek üzere Ziegler-Natta olefin polimerizasyonu için bir yardımcı katalizördür.
- Sulu alüminyum iyonları (sulu alüminyum sülfat gibi) Gyrodactylus salaris gibi balık parazitlerine karşı tedavide kullanılır.
- Birçok aşıda, bazı alüminyum tuzları, aşıdaki proteinin bağışıklık uyarıcı olarak yeterli güce ulaşmasını sağlamak için bir bağışıklık adjuvanı (bağışıklık tepkisi güçlendirici) görevi görür. ⓘ
Biyoloji

Yerkabuğunda yaygın olarak bulunmasına rağmen alüminyumun biyolojide bilinen bir işlevi yoktur. pH 6-9'da (çoğu doğal su için geçerlidir), alüminyum hidroksit olarak sudan çökelir ve bu nedenle kullanılamaz; bu şekilde davranan çoğu elementin biyolojik rolü yoktur veya toksiktir. Alüminyum sülfatın LD50 değeri 6207 mg/kg'dır (oral, fare), bu da 70 kg'lık (150 lb) bir insan için 435 grama karşılık gelir. ⓘ
Zehirlilik
Alüminyum, Amerika Birleşik Devletleri Sağlık ve İnsan Hizmetleri Bakanlığı tarafından kanserojen olmayan madde olarak sınıflandırılmıştır. 1988'de yayınlanan bir incelemede, alüminyuma normal maruziyetin sağlıklı yetişkinler için risk oluşturduğuna dair çok az kanıt olduğu belirtilmiş ve 2014'te yapılan çok elementli toksikoloji incelemesinde, vücut kütlesinin kg'ı başına 40 mg/gün'den fazla olmayan miktarlarda tüketilen alüminyumun zararlı etkileri bulunamamıştır. Tüketilen alüminyumun çoğu vücudu dışkı yoluyla terk eder; kan dolaşımına giren küçük bir kısmının çoğu idrar yoluyla atılır; yine de bir miktar alüminyum kan-beyin bariyerini geçer ve tercihen Alzheimer hastalarının beyinlerinde yerleşir. 1989'da yayınlanan kanıtlar, Alzheimer hastaları için alüminyumun proteinleri elektrostatik olarak çapraz bağlayarak etki gösterebileceğini ve böylece üst temporal girustaki genleri aşağı doğru düzenleyebileceğini göstermektedir. ⓘ
Etkileri
Alüminyum nadiren de olsa D vitaminine dirençli osteomalazi, eritropoietine dirençli mikrositik anemi ve merkezi sinir sistemi değişikliklerine neden olabilir. Böbrek yetmezliği olan kişiler özellikle risk altındadır. Kronik hidratlı alüminyum silikat alımı (aşırı mide asiditesini kontrol etmek için) alüminyumun bağırsak içeriğine bağlanmasına ve demir veya çinko gibi diğer metallerin eliminasyonunun artmasına neden olabilir; yeterince yüksek dozlar (>50 g/gün) anemiye neden olabilir. ⓘ
1988 Camelford su kirliliği olayı sırasında Camelford'daki insanların içme suları birkaç hafta boyunca alüminyum sülfat ile kirlenmiştir. Olayla ilgili olarak 2013 yılında hazırlanan nihai raporda, bu durumun uzun vadeli sağlık sorunlarına yol açma ihtimalinin düşük olduğu sonucuna varılmıştır. ⓘ
Alüminyumun Alzheimer hastalığının olası bir nedeni olduğundan şüphelenilmektedir, ancak 40 yılı aşkın süredir bu konuda yapılan araştırmalar 2018 itibariyle nedensel etkiye dair iyi bir kanıt bulamamıştır. ⓘ
Alüminyum, laboratuvarda kültüre edilen insan meme kanseri hücrelerinde östrojenle ilişkili gen ifadesini artırır. Çok yüksek dozlarda alüminyum, kan-beyin bariyerinin işlevinin değişmesiyle ilişkilendirilmektedir. İnsanların küçük bir yüzdesinde alüminyuma karşı temas alerjisi vardır ve alüminyum içeren ürünlerle temas ettiklerinde kaşıntılı kırmızı döküntüler, baş ağrısı, kas ağrısı, eklem ağrısı, zayıf hafıza, uykusuzluk, depresyon, astım, irritabl bağırsak sendromu veya diğer semptomlar yaşarlar. ⓘ
Toz alüminyum veya alüminyum kaynak dumanına maruz kalmak akciğer fibrozuna neden olabilir. İnce alüminyum tozu tutuşabilir veya patlayabilir, bu da başka bir işyeri tehlikesi oluşturur. ⓘ
Maruz kalma yolları
Yiyecekler alüminyumun ana kaynağıdır. İçme suyu katı gıdalardan daha fazla alüminyum içerir; ancak gıdalardaki alüminyum, sudaki alüminyumdan daha fazla emilebilir. İnsanların ağız yoluyla alüminyuma maruz kalmasının başlıca kaynakları arasında gıda (gıda katkı maddelerinde, yiyecek ve içecek ambalajlarında ve pişirme kaplarında kullanılması nedeniyle), içme suyu (kentsel su arıtımında kullanılması nedeniyle) ve alüminyum içeren ilaçlar (özellikle antiasit/anti-ülser ve tamponlu aspirin formülasyonları) yer almaktadır. Avrupalılarda diyetle maruziyet ortalama 0,2-1,5 mg/kg/hafta olmakla birlikte 2,3 mg/kg/hafta kadar yüksek olabilir. Daha yüksek alüminyum maruziyet seviyeleri çoğunlukla madenciler, alüminyum üretim işçileri ve diyaliz hastaları ile sınırlıdır. ⓘ
Antiasitler, ter önleyiciler, aşılar ve kozmetik ürünlerinin tüketimi olası maruziyet yollarını oluşturmaktadır. Asidik gıdaların veya alüminyum içeren sıvıların tüketimi alüminyum emilimini artırır ve maltolün sinir ve kemik dokularında alüminyum birikimini artırdığı gösterilmiştir. ⓘ
Tedavi
Ani olarak yüksek miktarda alüminyum alımından şüphelenilmesi durumunda, tek tedavi alüminyumun şelasyon yoluyla vücuttan atılmasına yardımcı olmak için verilebilecek deferoksamin mesilattır. Ancak, bu sadece alüminyumun değil, bakır veya demir gibi diğer metallerin de vücut seviyelerini düşürdüğü için dikkatli bir şekilde uygulanmalıdır. ⓘ
Çevresel etkiler
Maden sahalarının yakınlarında yüksek seviyelerde alüminyum oluşmakta; kömürle çalışan enerji santrallerinde veya yakma fırınlarında çevreye az miktarda alüminyum salınmaktadır. Havadaki alüminyum yağmurla yıkanır veya normalde çökelir ancak küçük alüminyum parçacıkları uzun süre havada kalır. ⓘ
Asidik çökelme, alüminyumu doğal kaynaklardan harekete geçiren ana doğal faktördür ve alüminyumun çevresel etkilerinin ana nedenidir; ancak tuzlu ve tatlı sularda alüminyum bulunmasının ana faktörü, alüminyumu havaya da salan endüstriyel işlemlerdir. ⓘ
Suda alüminyum, su asidik olduğunda balıklar gibi solungaç solunumu yapan hayvanlar üzerinde toksik bir ajan olarak hareket eder, alüminyum solungaçlarda çökelebilir, bu da plazma ve hemolenf iyonlarının kaybına neden olarak osmoregülasyon yetmezliğine yol açar. Alüminyumun organik kompleksleri kolayca emilebilir ve pratikte nadiren gerçekleşse de memelilerde ve kuşlarda metabolizmaya müdahale edebilir. ⓘ
Alüminyum, asidik topraklarda bitki büyümesini azaltan faktörlerin başında gelir. Genellikle pH nötr topraklarda bitki büyümesi için zararsız olmasına rağmen, asit topraklarda toksik Al3+ katyonlarının konsantrasyonu artar ve kök büyümesini ve işlevini bozar. Buğday, zararlı alüminyum katyonlarına bağlanan organik bileşikler salgılayarak alüminyuma karşı bir tolerans geliştirmiştir. Sorgumun da aynı tolerans mekanizmasına sahip olduğuna inanılmaktadır. ⓘ
Alüminyum üretimi, üretim sürecinin her aşamasında çevreye karşı kendi zorluklarına sahiptir. En büyük zorluk sera gazı emisyonlarıdır. Bu gazlar, eritme tesislerinin elektrik tüketiminden ve işlemenin yan ürünlerinden kaynaklanmaktadır. Bu gazların en güçlüsü eritme işleminden kaynaklanan perflorokarbonlardır. Salınan sülfür dioksit asit yağmurlarının başlıca öncülerinden biridir. ⓘ
2001'deki bir İspanyol bilimsel raporunda Geotrichum candidum mantarının kompakt disklerdeki alüminyumu tükettiği iddia edilmiştir. Diğer raporların hepsi bu rapora atıfta bulunmaktadır ve destekleyici hiçbir orijinal araştırma yoktur. Daha iyi belgelenmiş olan Pseudomonas aeruginosa bakterisi ve Cladosporium resinae mantarı, kerosen bazlı yakıtlar (havagazı değil) kullanan uçak yakıt tanklarında yaygın olarak tespit edilmektedir ve laboratuvar kültürleri alüminyumu bozabilmektedir. Ancak bu yaşam formları alüminyuma doğrudan saldırmaz veya onu tüketmez; bunun yerine metal mikrop atık ürünleri tarafından aşındırılır. ⓘ
Kimyası
Oksidasyon kademesi 1
- Alüminyum hidrojen atmosferi altında 1500 °C ye ısıtıldığında AlH üretilir.
- Alüminyumun normal oksidi (Al2O3) silisyum ile 1800 °C de vakum altında ısıtıldığında Al2O üretilir.
- Al2S3 ün alüminyum talaşları ile 1300 °C de vakum altında ısıtılması ile Al2S üretilir. Ancak hızlıca başlangıç maddelerine ayrışır. İki değerlikli selenyum da benzer şekilde yapılır.
- Üç değerlikli halojenürleri, alüminyum ile ısıtıldıklarında -AlF- -AlCl- ve -AlBr- gaz fazında elde edilebilir. ⓘ
Oksidasyon kademesi 2
- Alüminyum tozu oksijenle yandığında alüminyum alt-oksidinin (AlO) varlığı gösterilebilir. ⓘ

