Berilyum
 | |||||||||||||||||||||||
| Berilyum | |||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Telaffuz | /bəˈrɪliəm/ (bə-RIL-ee-əm) | ||||||||||||||||||||||
| Görünüş | beyaz-gri metalik | ||||||||||||||||||||||
| Standart atom ağırlığı Ar°(Be) |
| ||||||||||||||||||||||
| Periyodik tabloda berilyum | |||||||||||||||||||||||
| |||||||||||||||||||||||
| Atom numarası (Z) | 4 | ||||||||||||||||||||||
| Grup | grup 2 (toprak alkali metaller) | ||||||||||||||||||||||
| Dönem | dönem 2 | ||||||||||||||||||||||
| Blok | s-blok | ||||||||||||||||||||||
| Elektron konfigürasyonu | [[[Helyum|He]]] 2s2 | ||||||||||||||||||||||
| Kabuk başına elektron | 2, 2 | ||||||||||||||||||||||
| Fiziksel özellikler | |||||||||||||||||||||||
| STP'de Faz | katı | ||||||||||||||||||||||
| Erime noktası | 1560 K (1287 °C, 2349 °F) | ||||||||||||||||||||||
| Kaynama noktası | 2742 K (2469 °C, 4476 °F) | ||||||||||||||||||||||
| Yoğunluk (r.t.'ye yakın) | 1,85 g/cm3 | ||||||||||||||||||||||
| sıvı olduğunda (m.p.'de) | 1.690 g/cm3 | ||||||||||||||||||||||
| Kritik nokta | 5205 K, MPa (ekstrapole edilmiş) | ||||||||||||||||||||||
| Füzyon ısısı | 12,2 kJ/mol | ||||||||||||||||||||||
| Buharlaşma ısısı | 292 kJ/mol | ||||||||||||||||||||||
| Molar ısı kapasitesi | 16,443 J/(mol-K) | ||||||||||||||||||||||
Buhar basıncı
| |||||||||||||||||||||||
| Atomik özellikler | |||||||||||||||||||||||
| Oksidasyon durumları | 0, +1, +2 (amfoterik bir oksit) | ||||||||||||||||||||||
| Elektronegatiflik | Pauling ölçeği: 1.57 | ||||||||||||||||||||||
| İyonlaşma enerjileri |
| ||||||||||||||||||||||
| Atomik yarıçap | ampi̇ri̇k: 112 pm | ||||||||||||||||||||||
| Kovalent yarıçap | 96±3 pm | ||||||||||||||||||||||
| Van der Waals yarıçapı | 153 pm | ||||||||||||||||||||||
| Berilyumun spektral çizgileri | |||||||||||||||||||||||
| Diğer özellikler | |||||||||||||||||||||||
| Doğal oluşum | ilkel | ||||||||||||||||||||||
| Kristal yapı | altıgen yakın paketlenmiş (hcp) | ||||||||||||||||||||||
| Ses hızı ince çubuk | 12,890 m/s (r.t.'de) | ||||||||||||||||||||||
| Termal genleşme | 11,3 µm/(m⋅K) (25 °C'de) | ||||||||||||||||||||||
| Termal iletkenlik | 200 W/(m⋅K) | ||||||||||||||||||||||
| Elektriksel direnç | 36 nΩ⋅m (20 °C'de) | ||||||||||||||||||||||
| Manyetik sıralama | diamanyetik | ||||||||||||||||||||||
| Molar manyetik duyarlılık | -9.0×10-6 cm3/mol | ||||||||||||||||||||||
| Young modülü | 287 GPa | ||||||||||||||||||||||
| Kayma modülü | 132 GPa | ||||||||||||||||||||||
| Yığın modülü | 130 GPa | ||||||||||||||||||||||
| Poisson oranı | 0.032 | ||||||||||||||||||||||
| Mohs sertliği | 5.5 | ||||||||||||||||||||||
| Vickers sertliği | 1670 MPa | ||||||||||||||||||||||
| Brinell sertliği | 590-1320 MPa | ||||||||||||||||||||||
| CAS Numarası | 7440-41-7 | ||||||||||||||||||||||
| Tarih | |||||||||||||||||||||||
| Keşif | Louis Nicolas Vauquelin (1798) | ||||||||||||||||||||||
| İlk izolasyon | Friedrich Wöhler & Antoine Bussy (1828) | ||||||||||||||||||||||
| Berilyumun ana izotopları | |||||||||||||||||||||||
| |||||||||||||||||||||||
Berilyum, Be sembolüne ve 4 atom numarasına sahip kimyasal bir elementtir. Çelik grisi renginde, güçlü, hafif ve kırılgan bir toprak alkali metaldir. Doğal olarak sadece mineral oluşturmak için diğer elementlerle birlikte oluşan iki değerlikli bir elementtir. Berilyum oranı yüksek değerli taşlar arasında beril (akuamarin, zümrüt) ve krizoberil sayılabilir. Evrende nispeten nadir bulunan bir elementtir, genellikle kozmik ışınlarla çarpışan daha büyük atom çekirdeklerinin parçalanmasının bir ürünü olarak ortaya çıkar. Yıldızların çekirdekleri içinde berilyum, daha ağır elementlere kaynaştıkça tükenir. Berilyum, yerkabuğunun kütlece yaklaşık yüzde 0,0004'ünü oluşturur. Dünyadaki yıllık 220 tonluk berilyum üretimi genellikle beril mineralinden ekstraksiyon yoluyla üretilir, bu zor bir süreçtir çünkü berilyum oksijene güçlü bir şekilde bağlanır. ⓘ
Yapısal uygulamalarda, yüksek eğilme sertliği, termal stabilite, termal iletkenlik ve düşük yoğunluk (suyun 1,85 katı) kombinasyonu, berilyum metalini uçak bileşenleri, füzeler, uzay araçları ve uydular için arzu edilen bir havacılık malzemesi haline getirir. Düşük yoğunluğu ve atomik kütlesi nedeniyle, berilyum X-ışınlarına ve diğer iyonlaştırıcı radyasyon biçimlerine karşı nispeten şeffaftır; bu nedenle, X-ışını ekipmanı ve parçacık dedektörlerinin bileşenleri için en yaygın pencere malzemesidir. Alüminyum, bakır (özellikle berilyum bakır alaşımı), demir veya nikele alaşım elementi olarak eklendiğinde, berilyum birçok fiziksel özelliği geliştirir. Örneğin, berilyum bakır alaşımlarından yapılan aletler ve bileşenler güçlü ve serttir ve çelik bir yüzeye çarptıklarında kıvılcım oluşturmazlar. Havada, berilyum yüzeyi oda sıcaklığında kolayca oksitlenerek 1-10 nm kalınlığında bir pasivasyon tabakası oluşturur ve bu da onu daha fazla oksidasyon ve korozyondan korur. Metal, 500 °C'nin (932 °F) üzerinde ısıtıldığında kütle halinde (pasivasyon tabakasının ötesinde) oksitlenir ve yaklaşık 2.500 °C'ye (4.530 °F) ısıtıldığında parlak bir şekilde yanar. ⓘ
Berilyumun ticari kullanımı, solunan berilyum içeren tozların toksisitesi nedeniyle her zaman uygun toz kontrol ekipmanı ve endüstriyel kontrollerin kullanılmasını gerektirir, bu da bazı insanlarda berilyoz adı verilen kronik yaşamı tehdit eden alerjik bir hastalığa neden olabilir. Berilyoz pnömoniye ve diğer ilişkili solunum yolu hastalıklarına neden olur. ⓘ

Berilyum, periyodik tablonun II-A grubunda yer alan toprak alkali grubundan element. Berilyum ender elementlerdendir. Yerkabuğunda ancak %0,0006 oranında bulunur. Zengin yatakları bulunmadığından, berilden elde edilir. Fransız kimyacısı Nicolas Vaquelin tarafından 1798'de oksit halinde bulunmuş, 1828'de, birbirlerinden bağımsız olarak, Friedrich Wöhler ve Antoine Bussy tarafından elde edilmiştir. ⓘ
Alüminyumdan daha hafif, ama daha sert, erime noktası da yüksek bir element olan berilyum, metalurjide kullanılır. Ama alüminyumdan 200 kat pahalıya mal olması nedeniyle, kullanımı bilgisayar parçaları ve jiroskop yapımı, uzay teknolojisi gibi birkaç özel alanla sınırlıdır. ⓘ
Özellikler
Fiziksel özellikler
Berilyum, oda sıcaklığında kırılgan olan ve yakın paketlenmiş altıgen kristal yapıya sahip çelik grisi ve sert bir metaldir. Olağanüstü bir sertliğe (Young modülü 287 GPa) ve 1287 °C'lik bir erime noktasına sahiptir. Berilyumun elastikiyet modülü çeliğinkinden yaklaşık %50 daha fazladır. Bu modül ve nispeten düşük yoğunluğun birleşimi, berilyumda alışılmadık derecede hızlı bir ses iletim hızı ile sonuçlanır - ortam koşullarında yaklaşık 12,9 km/s. Diğer önemli özellikleri ise yüksek özgül ısı (1925 J-kg-1-K-1) ve termal iletkenlik (216 W-m-1-K-1) olup berilyumu birim ağırlık başına en iyi ısı yayma özelliklerine sahip metal yapmaktadır. Nispeten düşük doğrusal termal genleşme katsayısı (11.4×10-6 K-1) ile birlikte bu özellikler, termal yükleme koşulları altında benzersiz bir kararlılıkla sonuçlanır. ⓘ
Nükleer özellikler
Doğal olarak oluşan berilyum, kozmojenik radyoizotopların hafif kontaminasyonu dışında, nükleer spini 3/2 olan izotopik olarak saf berilyum-9'dur. Berilyum yüksek enerjili nötronlar için büyük bir saçılma kesitine sahiptir, yaklaşık 10 keV üzerindeki enerjiler için yaklaşık 6 barn. Bu nedenle, nötron yansıtıcı ve nötron moderatörü olarak çalışarak nötronları 0,03 eV'nin altındaki termal enerji aralığına etkili bir şekilde yavaşlatır, burada toplam tesir kesiti en az bir büyüklük sırası daha düşüktür; kesin değer büyük ölçüde malzemedeki kristalitlerin saflığına ve boyutuna bağlıdır. ⓘ
Tek primordiyal berilyum izotopu 9Be de nötron enerjileri yaklaşık 1,9 MeV'in üzerinde olan bir (n,2n) nötron reaksiyonuna girerek 8Be üretir ve bu da neredeyse hemen iki alfa parçacığına ayrılır. Dolayısıyla, yüksek enerjili nötronlar için berilyum bir nötron çarpanıdır ve absorbe ettiğinden daha fazla nötron salar. Bu nükleer reaksiyon:
- 9
4Be
+ n → 2 4
2He
+ 2 n ⓘ
Berilyum çekirdekleri enerjik alfa parçacıkları tarafından vurulduğunda nötronlar serbest kalır ve nükleer reaksiyon meydana gelir
- 9
4Be
+ 4
2He
→ 12
6C
+ n
nerede 4
2He
bir alfa parçacığı ve 12
6C
bir karbon-12 çekirdeğidir.
Berilyum ayrıca gama ışınları tarafından bombardıman edildiğinde nötronları serbest bırakır. Bu nedenle, uygun bir radyoizotoptan gelen alfa ya da gama ışınlarıyla bombardıman edilen doğal berilyum, serbest nötronların laboratuvar üretimi için radyoizotopla çalışan nükleer reaksiyon nötron kaynaklarının çoğunun temel bileşenidir. ⓘ
Küçük miktarlarda trityum, 9
4Be
Çekirdekler üç aşamalı nükleer reaksiyonda düşük enerjili nötronları emer
- 9
4Be
+ n → 4
2He
+ 6
2He
, 6
2He
→ 6
3Li
+ β−, 6
3Li
+ n → 4
2He
+ 3
1H
6 olduğunu unutmayın
2He
sadece 0,8 saniyelik bir yarı ömre sahiptir, β- bir elektrondur ve 6
3Li
yüksek bir nötron soğurma kesitine sahiptir. Trityum, nükleer reaktör atık akışlarında endişe verici bir radyoizotoptur. ⓘ
Optik özellikler
Bir metal olarak berilyum, X-ışınları ve gama ışınlarının çoğu dalga boyuna karşı saydam veya yarı saydamdır, bu da onu X-ışını tüplerinin ve diğer bu tür cihazların çıkış pencereleri için kullanışlı hale getirir. ⓘ
İzotoplar ve nükleosentez
Berilyumun hem kararlı hem de kararsız izotopları yıldızlarda yaratılır, ancak radyoizotoplar uzun ömürlü değildir. Evrendeki kararlı berilyumun çoğunun, kozmik ışınların yıldızlararası gaz ve tozda bulunan daha ağır elementlerde fisyona neden olmasıyla yıldızlararası ortamda oluştuğuna inanılmaktadır. Primordial berilyum sadece bir kararlı izotop, 9Be içerir ve bu nedenle berilyum monoizotopik ve mononüklidik bir elementtir. ⓘ

Radyoaktif kozmojenik 10Be, Dünya atmosferinde kozmik ışınların oksijeni parçalamasıyla üretilir. 10Be, nispeten uzun yarı ömrünün (1,36 milyon yıl) bor-10'a bozunmadan önce uzun bir kalma süresine izin verdiği toprak yüzeyinde birikir. Bu nedenle, 10Be ve yan ürünleri doğal toprak erozyonunu, toprak oluşumunu ve lateritik toprakların gelişimini incelemek için ve güneş aktivitesindeki değişimleri ve buz çekirdeklerinin yaşını ölçmek için bir vekil olarak kullanılır. 10Be üretimi güneş aktivitesiyle ters orantılıdır, çünkü yüksek güneş aktivitesi dönemlerinde artan güneş rüzgarı, Dünya'ya ulaşan galaktik kozmik ışınların akışını azaltır. Nükleer patlamalar da hızlı nötronların havadaki karbondioksitte bulunan 13C ile reaksiyona girmesi sonucu 10Be oluşturur. Bu, nükleer silah test sahalarındaki geçmiş faaliyetlerin göstergelerinden biridir. 7Be izotopu (yarı ömrü 53 gün) da kozmojeniktir ve 10Be gibi güneş lekeleriyle bağlantılı bir atmosferik bolluk gösterir. ⓘ
Berilyumdan daha ağır elementler Büyük Patlama'da nükleer füzyonla üretilemediğinden, 8Be'nin yaklaşık 8×10-17 s gibi çok kısa bir yarı ömrü vardır ve bu da önemli kozmolojik rolüne katkıda bulunur. Bunun nedeni, Büyük Patlama'nın nükleosentez aşamasında 4He çekirdeklerinin füzyonu yoluyla karbon üretmek için yeterli zamanın olmaması ve mevcut berilyum-8 konsantrasyonlarının çok düşük olmasıdır. İngiliz astronom Sir Fred Hoyle ilk olarak 8Be ve 12C enerji seviyelerinin, daha fazla nükleosentez zamanının mevcut olduğu helyum yakıtlı yıldızlarda üçlü-alfa süreci olarak adlandırılan karbon üretimine izin verdiğini göstermiştir. Bu süreç karbonun yıldızlarda üretilmesine izin verirken Büyük Patlama'da üretilmesine izin vermemektedir. Dolayısıyla yıldızlarda üretilen karbon (karbon temelli yaşamın temeli), AGB yıldızları ve süpernovalar tarafından püskürtülen gaz ve tozdaki elementlerin bir bileşenidir (ayrıca bkz. Büyük Patlama nükleosentezi) ve karbondan daha büyük atom numaralarına sahip diğer tüm elementlerin oluşumunu sağlar. ⓘ
Berilyumun 2s elektronları kimyasal bağlanmaya katkıda bulunabilir. Bu nedenle, 7Be L-elektron yakalama yoluyla bozunduğunda, bunu atomik orbitallerinden bağlanmaya katılıyor olabilecek elektronları alarak yapar. Bu da bozunma hızını ölçülebilir bir dereceye kadar kimyasal çevresine bağımlı hale getirir ki bu nükleer bozunmada nadir görülen bir durumdur. ⓘ
Berilyumun bilinen en kısa ömürlü izotopu 16Be'dir ve nötron emisyonu yoluyla 6,5×10-22 s yarı ömürle bozunur. 11Be ve 14Be egzotik izotoplarının bir nükleer halo sergilediği bilinmektedir. Bu olgu, 11Be ve 14Be çekirdeklerinin, çekirdeğin klasik Fermi 'su damlası' modelinin büyük ölçüde dışında yörüngede dönen sırasıyla 1 ve 4 nötrona sahip olmasıyla anlaşılabilir. ⓘ
Oluşum


Güneş milyarda 0,1 parça (ppb) berilyum konsantrasyonuna sahiptir. Berilyum, Dünya'nın kabuğunda milyonda 2 ila 6 parça (ppm) konsantrasyona sahiptir. En yoğun olarak 6 ppm ile toprakta bulunur. Dünya atmosferinde eser miktarda 9Be bulunur. Deniz suyundaki berilyum konsantrasyonu trilyonda 0,2-0,6 parçadır. Akarsu suyunda ise berilyum 0,1 ppb'lik bir konsantrasyonla daha bol miktarda bulunur. ⓘ
Berilyum 100'den fazla mineralde bulunur, ancak çoğu nadir veya nadirdir. Daha yaygın berilyum içeren mineraller şunlardır: bertrandit (Be4Si2O7(OH)2), beril (Al2Be3Si6O18), krizoberil (Al2BeO4) ve fenakit (Be2SiO4). Değerli beril formları akuamarin, kırmızı beril ve zümrüttür. Berilin mücevher kalitesindeki formlarındaki yeşil renk, değişen miktarlardaki kromdan gelir (zümrüt için yaklaşık %2). ⓘ
Berilyumun iki ana cevheri olan beril ve bertrandit Arjantin, Brezilya, Hindistan, Madagaskar, Rusya ve Amerika Birleşik Devletleri'nde bulunur. Dünyadaki toplam berilyum cevheri rezervi 400.000 tondan fazladır. ⓘ
Üretim
Berilyumun bileşiklerinden çıkarılması, yüksek sıcaklıklarda oksijene olan yüksek afinitesi ve oksit filmi çıkarıldığında suyu azaltma kabiliyeti nedeniyle zor bir işlemdir. Şu anda Amerika Birleşik Devletleri, Çin ve Kazakistan berilyumun endüstriyel ölçekte çıkarılmasında yer alan üç ülkedir. Kazakistan, 1991 yılında Sovyetler Birliği'nin dağılmasından önce stoklanan bir konsantreden berilyum üretmektedir. Bu kaynak 2010'ların ortalarında neredeyse tükenmiştir. ⓘ
Rusya'da berilyum üretimi 1997 yılında durdurulmuştur ve 2020'lerde yeniden başlatılması planlanmaktadır. ⓘ
Berilyum en yaygın olarak ya bir ekstraksiyon maddesi kullanılarak sinterlenen ya da eritilerek çözünür bir karışım haline getirilen beril mineralinden çıkarılır. Sinterleme işlemi, sodyum floroberilat, alüminyum oksit ve silikon dioksit oluşturmak için berilin 770 °C'de (1.420 °F) sodyum florosilikat ve soda ile karıştırılmasını içerir. Berilyum hidroksit, sudaki bir sodyum floroberilat ve sodyum hidroksit çözeltisinden çökeltilir. Berilyumun eriyik yöntemi kullanılarak çıkarılması, berilin toz haline getirilmesini ve 1.650 °C'ye (3.000 °F) ısıtılmasını içerir. Eriyik hızla su ile soğutulur ve ardından konsantre sülfürik asit içinde 250 ila 300 °C (482 ila 572 °F) yeniden ısıtılır, çoğunlukla berilyum sülfat ve alüminyum sülfat elde edilir. Sulu amonyak daha sonra alüminyum ve sülfürü uzaklaştırmak için kullanılır ve geriye berilyum hidroksit kalır. ⓘ
Sinter veya eriyik yöntemi kullanılarak oluşturulan berilyum hidroksit daha sonra berilyum florür veya berilyum klorüre dönüştürülür. Florürü oluşturmak için berilyum hidroksite sulu amonyum hidrojen florür eklenerek amonyum tetrafloroberilat çökeltisi elde edilir ve bu çökelti 1.000 °C'ye (1.830 °F) kadar ısıtılarak berilyum florür oluşturulur. Florürün magnezyum ile 900 °C'ye (1.650 °F) ısıtılması ince bölünmüş berilyum oluşturur ve 1.300 °C'ye (2.370 °F) ilave ısıtma kompakt metali oluşturur. Berilyum hidroksitin ısıtılması, karbon ve klor ile birleştirildiğinde berilyum klorür haline gelen oksidi oluşturur. Erimiş berilyum klorürün elektrolizi daha sonra metali elde etmek için kullanılır. ⓘ
Kimyasal özellikler
Bir berilyum atomu [He] 2s2 elektronik konfigürasyonuna sahiptir. Berilyumun baskın oksidasyon durumu +2'dir; berilyum atomu her iki değerlik elektronunu da kaybetmiştir. Daha düşük oksidasyon durumları, örneğin bis(karben) bileşiklerinde bulunmuştur. Berilyumun kimyasal davranışı büyük ölçüde küçük atomik ve iyonik yarıçapının bir sonucudur. Bu nedenle çok yüksek iyonlaşma potansiyeline ve diğer atomlara bağlıyken güçlü polarizasyona sahiptir, bu yüzden tüm bileşikleri kovalenttir. Kimyası, çapraz ilişkinin bir örneği olan alüminyumun kimyası ile benzerlikler gösterir. ⓘ
Oda sıcaklığında, berilyumun yüzeyi, oksidin yaklaşık 25 nm'ye kadar kademeli olarak kalınlaşması dışında, hava ile daha fazla reaksiyonu önleyen 1-10 nm kalınlığında bir oksit pasivasyon tabakası oluşturur. Yaklaşık 500 °C'nin üzerinde ısıtıldığında, yığın metale oksidasyon tane sınırları boyunca ilerler. Metal, 2500 °C civarında oksit erime noktasının üzerinde ısıtılarak havada tutuşturulduğunda, berilyum parlak bir şekilde yanarak berilyum oksit ve berilyum nitrür karışımı oluşturur. Berilyum, HCl ve seyreltilmiş H2SO4 gibi oksitleyici olmayan asitlerde kolayca çözünür, ancak nitrik asit veya suda çözünmez, çünkü bu oksit oluşturur. Bu davranış alüminyum metalininkine benzer. Berilyum alkali çözeltilerde de çözünür. ⓘ
Berilyum(II)'nin ikili bileşikleri katı halde polimeriktir. BeF2, köşe paylaşımlı BeF4 tetrahedraları ile silika benzeri bir yapıya sahiptir. BeCl2 ve BeBr2, kenar paylaşımlı tetrahedralı zincir yapılarına sahiptir. Berilyum oksit, BeO, wurtzite kristal yapısına ve bazı metaller kadar yüksek termal iletkenliğe sahip beyaz refrakter bir katıdır. BeO amfoteriktir. Berilyum sülfür, selenid ve tellürid bilinmektedir ve hepsi çinkoblende yapısına sahiptir. Berilyum nitrür, Be3N2 kolayca hidrolize olan yüksek erime noktalı bir bileşiktir. Berilyum azid, BeN6 bilinmektedir ve berilyum fosfit, Be3P2, Be3N2'ye benzer bir yapıya sahiptir. Be5B, Be4B, Be2B, BeB2, BeB6 ve BeB12 gibi bir dizi berilyum borür bilinmektedir. Berilyum karbür, Be2C, metan vermek için su ile reaksiyona giren refrakter tuğla kırmızısı bir bileşiktir. Hiçbir berilyum silisit tanımlanmamıştır. ⓘ
BeX2 halojenürleri (X = F, Cl, Br, I) gaz fazında doğrusal bir monomerik moleküler yapıya sahiptir. Halojenürlerin kompleksleri, toplam iki çift elektron bağışlayan bir veya daha fazla ligand ile oluşturulur. Bu tür bileşikler oktet kuralına uyar. Su-iyonu [Be(H2O)4]2+ gibi diğer 4-koordinatlı kompleksler de oktet kuralına uyar. ⓘ
Sulu çözeltiler
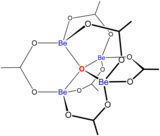
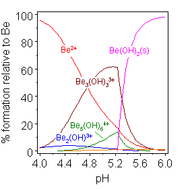

Berilyumun sulu çözelti kimyası kapsamlı bir incelemenin konusudur. Berilyum sülfat ve berilyum nitrat gibi berilyum tuzlarının çözeltileri, [Be(H2O)4]2+ iyonunun hidrolizi nedeniyle asidiktir. İlk hidroliz ürünü olan [Be(H2O)3(OH)]+ konsantrasyonu berilyum konsantrasyonunun %1'inden daha azdır. En kararlı hidroliz ürünü [Be3(OH)3(H2O)6]3+ trimerik iyonudur. Berilyum hidroksit, Be(OH)2, pH 5 veya daha yüksek değerlerde suda çözünmez. Sonuç olarak, berilyum bileşikleri genellikle biyolojik pH'da çözünmez. Bu nedenle, berilyum metal tozunun insanlar tarafından solunması ölümcül berilyoz durumunun gelişmesine yol açar. Be(OH)2 güçlü alkali çözeltilerde çözünür. ⓘ
Berilyum(II), monodentat ligandlarla az sayıda kompleks oluşturur çünkü aquo-iyon içindeki su molekülleri, berilyum iyonuna çok güçlü bir şekilde bağlanır. Kayda değer istisnalar florür iyonu ile suda çözünen kompleks serileridir.
- Ayrıştırılamadı (bilinmeyen işlev "\seksendokuzka"): {\displaystyle \ce{[Be(H_2O)_4]^{2+} {+}n F^- \seksendokuzkaşık Be[(H_2O)_{2-n}F_n]^{(2-n)\pm} {+} nH_2O <span title="Kaynak: İngilizce Vikipedi, Bölüm "Aqueous solutions"" class="plainlinks">[https://en.wikipedia.org/wiki/Beryllium#Aqueous_solutions <span style="color:#dddddd">ⓘ</span>]</span>}}
Berilyum(II), oksijen-donör atomları içeren bidentat ligandlarla birçok kompleks oluşturur. Türler merkezinde 3 koordinatlı bir oksit iyonuna sahip olmasıyla dikkat çeker. Bazik berilyum asetat, berilyum atomlarından oluşan bir tetrahedron ile çevrili bir oksit iyonuna sahiptir. ⓘ
Malonat iyonu gibi organik ligandlarda, kompleks oluşturulurken asit protondan arındırılır. Donör atomlar iki oksijendir.
Bir kompleksin oluşumu metal iyonu-hidroliz reaksiyonu ile rekabet halindedir ve hem anyon hem de hidroksit iyonu ile karışık kompleksler de oluşur. Örneğin, bir veya daha fazla su molekülü çiftinin yerini alan bidentat bir ligand ile siklik trimer türevleri bilinmektedir. EDTA gibi ligandlar dikarboksilik asitler gibi davranır. ⓘ
Glikolik asit gibi hidroksikarboksilik asitler, hidroksil grubunun bozulmadan kaldığı çözeltide oldukça zayıf, monodentat kompleksler oluşturur. Bir hekzamer, hidroksil gruplarının deprotonlandığı katı halde uzun zaman önce izole edilmiştir. Aromatik di-hidroksi ligandlar nispeten güçlü kompleksler oluşturur. Örneğin, tiron ile kompleksler için 12.2 ve 9.3 log K1 ve log K2 değerleri rapor edilmiştir. ⓘ
Amino asitlerle komplekslere ilişkin birçok erken rapor vardır, ancak ne yazık ki bunlar güvenilir değildir, çünkü eşlik eden hidroliz reaksiyonları yayın sırasında anlaşılmamıştır. Log β için yaklaşık 6 ila 7 değerleri rapor edilmiştir. Hidroliz reaksiyonları ile rekabet nedeniyle oluşum derecesi küçüktür. ⓘ
Organik kimya
Organoberilyum kimyası, berilyum, berilyum türevleri ve berilyum klorür gibi berilyum girişi için gerekli reaktiflerin maliyeti ve toksisitesi nedeniyle akademik araştırmalarla sınırlıdır. Organometalik berilyum bileşiklerinin oldukça reaktif olduğu bilinmektedir Bilinen organoberilyum bileşiklerine örnek olarak dineopentilberilyum, berilosen (Cp2Be), dialilberilyum (dietil berilyumun trialil bor ile değişim reaksiyonu), bis(1,3-trimetilsililalil)berilyum ve Be(mes)2 verilebilir. Ligandlar ayrıca ariller ve alkiniller olabilir. ⓘ
Tarih
Berilyum içeren beril minerali en azından Mısır'ın Ptolemaic hanedanlığından beri kullanılmaktadır. MS birinci yüzyılda Romalı doğa bilimci Yaşlı Pliny, Doğa Tarihi ansiklopedisinde beril ve zümrütün ("smaragdus") benzer olduğundan bahsetmiştir. MS üçüncü veya dördüncü yüzyılda yazılmış olan Papirüs Graecus Holmiensis, yapay zümrüt ve berilin nasıl hazırlanacağına dair notlar içermektedir. ⓘ

Martin Heinrich Klaproth, Torbern Olof Bergman, Franz Karl Achard ve Johann Jakob Bindheim tarafından yapılan ilk zümrüt ve beril analizlerinde hep benzer elementler bulunmuş, bu da her iki maddenin de alüminyum silikat olduğu yanılgısına yol açmıştır. Mineralog René Just Haüy her iki kristalin de geometrik olarak aynı olduğunu keşfetti ve kimyager Louis-Nicolas Vauquelin'den kimyasal bir analiz istedi. ⓘ
Vauquelin, 1798 yılında Institut de France'da okuduğu bir makalede, zümrüt ve berilden elde edilen alüminyum hidroksiti ilave bir alkali içinde çözerek yeni bir "toprak" bulduğunu bildirdi. Annales de Chimie et de Physique dergisinin editörleri, bazı bileşiklerinin tatlı tadı nedeniyle yeni toprağa "glukin" adını verdiler. Klaproth, yttria'nın da tatlı tuzlar oluşturması nedeniyle "beryllina" adını tercih etti. "Berilyum" adı ilk kez 1828 yılında Wöhler tarafından kullanılmıştır. ⓘ

Friedrich Wöhler ve Antoine Bussy, 1828 yılında berilyumu, metalik potasyumun berilyum klorür ile aşağıdaki gibi kimyasal reaksiyona girmesiyle bağımsız olarak izole etmişlerdir:
- BeCl2 + 2 K → 2 KCl + Be
Wöhler, bir alkol lambası kullanarak, telle kapatılmış platin bir kroze içinde değişen berilyum klorür ve potasyum katmanlarını ısıttı. Yukarıdaki reaksiyon hemen gerçekleşti ve potanın beyaz sıcak olmasına neden oldu. Elde ettiği gri-siyah tozu soğutup yıkadığında, koyu metalik bir parlaklığa sahip ince parçacıklardan oluştuğunu gördü. Son derece reaktif potasyum, 21 yıl önce keşfedilen bir süreç olan bileşiklerinin elektroliziyle üretilmişti. Potasyum kullanılan kimyasal yöntemde sadece küçük berilyum taneleri elde ediliyordu ve bunlardan metal külçe dökülemiyor ya da dövülemiyordu. ⓘ
Paul Lebeau tarafından 1898 yılında erimiş berilyum florür ve sodyum florür karışımının doğrudan elektrolizi ilk saf (%99,5 ila 99,8) berilyum örneklerinin elde edilmesini sağladı. Ancak endüstriyel üretim ancak Birinci Dünya Savaşı'ndan sonra başlamıştır. İlk endüstriyel katılım Cleveland, Ohio'daki Union Carbide and Carbon Corporation ve Berlin'deki Siemens & Halske AG ile ilgili yan kuruluşları ve bilim adamlarını içeriyordu. ABD'de süreç Kemet Laboratories Company'nin yöneticisi Hugh S. Cooper tarafından yönetilmiştir. Almanya'da berilyum üretimi için ticari olarak başarılı ilk süreç 1921 yılında Alfred Stock ve Hans Goldschmidt tarafından geliştirilmiştir. ⓘ
James Chadwick tarafından 1932 yılında yapılan ve nötronun varlığını ortaya çıkaran bir deneyde, bir berilyum örneği radyumun bozunmasından kaynaklanan alfa ışınlarıyla bombardıman edildi. Aynı yöntem, her bir milyon α parçacığı için 30 nötron üreten radyoizotop tabanlı laboratuvar nötron kaynaklarının bir sınıfında da kullanılmaktadır. ⓘ
Berilyum üretimi, sert berilyum-bakır alaşımlarına ve floresan lambalar için fosforlara yönelik artan talep nedeniyle İkinci Dünya Savaşı sırasında hızlı bir artış gösterdi. İlk floresan lambaların çoğunda yeşilimsi ışık yaymak için değişen oranlarda berilyum içeren çinko ortosilikat kullanılmıştır. Küçük magnezyum tungstat ilaveleri spektrumun mavi kısmını iyileştirerek kabul edilebilir bir beyaz ışık elde edilmesini sağlamıştır. Berilyumun toksik olduğu anlaşıldıktan sonra berilyum bazlı fosforların yerini halofosfat bazlı fosforlar almıştır. ⓘ
Berilyum florür ve sodyum florür karışımının elektrolizi 19. yüzyılda berilyumu izole etmek için kullanılmıştır. Metalin yüksek erime noktası, bu işlemi alkali metaller için kullanılan ilgili işlemlerden daha fazla enerji tüketen bir işlem haline getirmektedir. 20. yüzyılın başlarında, zirkonyum üretimi için benzer bir işlemin başarısının ardından berilyum iyodürün termal ayrışması yoluyla berilyum üretimi araştırıldı, ancak bu işlemin hacimli üretim için ekonomik olmadığı kanıtlandı. ⓘ
Saf berilyum metali, çok daha önceleri bakırı sertleştirmek ve toklaştırmak için alaşım metali olarak kullanılmasına rağmen, 1957'ye kadar hazır hale gelmedi. Berilyum, berilyum klorür gibi berilyum bileşiklerinin metalik potasyum veya sodyum ile indirgenmesiyle üretilebilmiştir. Şu anda berilyumun çoğu, berilyum florürün magnezyum ile indirgenmesiyle üretilmektedir. Vakum döküm berilyum külçelerinin Amerikan pazarındaki fiyatı 2001 yılında pound başına yaklaşık 338 $ (kilogram başına 745 $) idi. ⓘ
1998 ve 2008 yılları arasında dünya berilyum üretimi 343 tondan yaklaşık 200 tona düşmüştür. Daha sonra 2018 yılına kadar 230 tona yükselmiş ve bunun 170 tonu Amerika Birleşik Devletleri'nden gelmiştir. ⓘ
Etimoloji
Adını ilk kez izole edildiği yarı değerli bir mineral olan berilden almıştır. ⓘ
Uygulamalar
Radyasyon pencereleri


Düşük atom numarası ve X-ışınları için çok düşük emilimi nedeniyle, berilyumun en eski ve hala en önemli uygulamalarından biri X-ışını tüpleri için radyasyon pencereleridir. X-ışını görüntülerinde artefaktları önlemek için berilyumun saflığı ve temizliği konusunda aşırı talepler vardır. İnce berilyum folyolar, X-ışını dedektörleri için radyasyon pencereleri olarak kullanılır ve son derece düşük emilim, senkrotron radyasyonuna özgü yüksek yoğunluklu, düşük enerjili X-ışınlarının neden olduğu ısıtma etkilerini en aza indirir. Sinkrotronlar üzerindeki radyasyon deneyleri için vakum geçirmez pencereler ve ışın tüpleri yalnızca berilyumdan üretilmektedir. Çeşitli X-ışını emisyon çalışmaları için bilimsel kurulumlarda (örneğin, enerji dağılımlı X-ışını spektroskopisi) örnek tutucu genellikle berilyumdan yapılır, çünkü yayılan X-ışınları, incelenen çoğu malzemeden gelen X-ışınlarından çok daha düşük enerjilere (≈100 eV) sahiptir. ⓘ
Düşük atom numarası da berilyumu enerjik parçacıklara karşı nispeten şeffaf hale getirir. Bu nedenle, Büyük Hadron Çarpıştırıcısındaki dört ana dedektör deneyi (ALICE, ATLAS, CMS, LHCb), Tevatron ve SLAC gibi parçacık fiziği kurulumlarında çarpışma bölgesi etrafındaki ışın borusunu inşa etmek için kullanılır. Berilyumun düşük yoğunluğu, çarpışma ürünlerinin önemli bir etkileşim olmadan çevredeki dedektörlere ulaşmasını sağlar, sertliği, gazlarla etkileşimi en aza indirmek için boru içinde güçlü bir vakum üretilmesine izin verir, termal kararlılığı, mutlak sıfırın sadece birkaç derece üzerindeki sıcaklıklarda doğru şekilde çalışmasını sağlar ve diyamanyetik yapısı, parçacık ışınlarını yönlendirmek ve odaklamak için kullanılan karmaşık çok kutuplu mıknatıs sistemleriyle etkileşime girmesini önler. ⓘ
Mekanik uygulamalar
Sertliği, hafifliği ve geniş bir sıcaklık aralığında boyutsal kararlılığı nedeniyle berilyum metali, savunma ve havacılık endüstrilerinde yüksek hızlı uçaklarda, güdümlü füzelerde, uzay araçlarında ve James Webb Uzay Teleskobu da dahil olmak üzere uydularda hafif yapısal bileşenler için kullanılır. Birçok sıvı yakıtlı rokette saf berilyumdan yapılmış roket nozulları kullanılmıştır. Berilyum tozunun kendisi de roket yakıtı olarak incelenmiştir, ancak bu kullanım hiçbir zaman gerçekleşmemiştir. Az sayıda üst düzey bisiklet kadrosu berilyum ile üretilmiştir. McLaren Formula 1 takımı 1998'den 2000'e kadar berilyum-alüminyum alaşımlı pistonlara sahip Mercedes-Benz motorları kullanmıştır. Berilyum motor bileşenlerinin kullanımı Scuderia Ferrari tarafından yapılan bir protesto sonrasında yasaklanmıştır. ⓘ
Bakıra yaklaşık %2,0 oranında berilyum karıştırılması, tek başına bakırdan altı kat daha güçlü olan berilyum bakır adı verilen bir alaşım oluşturur. Berilyum alaşımları, esneklik, yüksek elektrik iletkenliği ve termal iletkenlik, yüksek mukavemet ve sertlik, manyetik olmayan özelliklerin yanı sıra iyi korozyon ve yorulma direnci kombinasyonları nedeniyle birçok uygulamada kullanılmaktadır. Bu uygulamalar arasında yanıcı gazların yakınında kullanılan kıvılcım çıkarmayan aletler (berilyum nikel), cerrahi aletlerde ve yüksek sıcaklık cihazlarında kullanılan yaylar ve membranlar (berilyum nikel ve berilyum demir) yer almaktadır. Sıvı magnezyum ile alaşımlandırılmış milyonda 50 parça kadar az berilyum, oksidasyon direncinde önemli bir artışa ve yanıcılıkta azalmaya yol açar. ⓘ

Berilyumun yüksek elastik sertliği, hassas enstrümantasyonda, örneğin atalet yönlendirme sistemlerinde ve optik sistemler için destek mekanizmalarında yaygın olarak kullanılmasına yol açmıştır. Berilyum-bakır alaşımları ayrıca gemilerin gövdelerindeki boyayı sıyırmak için kullanılan "Jason tabancalarında" sertleştirici madde olarak uygulanmıştır. ⓘ
Berilyum aynı zamanda yüksek performanslı fonograf kartuş uçlarında kantileverler için de kullanıldı; burada aşırı sertliği ve düşük yoğunluğu, izleme ağırlıklarının 1 grama düşürülmesine izin verdi, ancak yine de yüksek frekanslı geçişleri minimum bozulma ile izledi. ⓘ
Berilyumun daha önceki önemli uygulamalarından biri, sertliği, yüksek erime noktası ve ısıyı dağıtma konusundaki olağanüstü yeteneği nedeniyle askeri uçakların frenleriydi. Çevresel kaygılar diğer malzemelerle ikame edilmesine yol açmıştır. ⓘ
Maliyetleri düşürmek için berilyum önemli miktarlarda alüminyum ile alaşım haline getirilebilir ve sonuçta AlBeMet alaşımı (ticari bir isim) elde edilir. Bu karışım saf berilyumdan daha ucuzdur, ancak yine de istenen birçok özelliği korur. ⓘ
Aynalar
Berilyum aynalar özellikle ilgi çekicidir. Sıklıkla bal peteği destek yapısına sahip geniş alanlı aynalar, örneğin düşük ağırlık ve uzun vadeli boyutsal kararlılığın kritik olduğu meteoroloji uydularında kullanılmaktadır. Daha küçük berilyum aynalar optik yönlendirme sistemlerinde ve örneğin Alman yapımı Leopard 1 ve Leopard 2 ana muharebe tanklarında olduğu gibi ateş kontrol sistemlerinde kullanılmaktadır. Bu sistemlerde aynanın çok hızlı hareket etmesi gerekir ki bu da yine düşük kütle ve yüksek sertlik gerektirir. Genellikle berilyum ayna, berilyumdan daha ince bir optik cilaya daha kolay parlatılabilen sert akımsız nikel kaplama ile kaplanır. Ancak bazı uygulamalarda, berilyum işlenmemiş parça herhangi bir kaplama olmadan parlatılır. Bu özellikle termal genleşme uyumsuzluğunun kaplamanın bükülmesine neden olabileceği kriyojenik operasyonlar için geçerlidir. ⓘ
James Webb Uzay Teleskobu, aynaları için her biri ince bir altın tabakasıyla kaplanmış 18 altıgen berilyum bölüme sahiptir. JWST 33 K sıcaklığa maruz kalacağı için ayna, aşırı soğukla camdan daha iyi başa çıkabilen altın kaplama berilyumdan yapılmıştır. Berilyum bu tür sıcaklıklarda cama göre daha az büzülür ve deforme olur - ve daha düzgün kalır. Aynı nedenle Spitzer Uzay Teleskobu'nun optikleri de tamamen berilyum metalinden yapılmıştır. ⓘ
Manyetik uygulamalar

Berilyum manyetik değildir. Bu nedenle, berilyum bazlı malzemelerden imal edilen aletler, deniz mayınları üzerinde veya yakınında çalışmak için deniz veya askeri patlayıcı mühimmat imha ekipleri tarafından kullanılır, çünkü bu mayınlar genellikle manyetik tapalara sahiptir. Ayrıca, üretilen yüksek manyetik alanlar nedeniyle manyetik rezonans görüntüleme (MRI) makinelerinin yakınındaki bakım ve inşaat malzemelerinde de bulunurlar. Radyo iletişimi ve güçlü (genellikle askeri) radarlar alanlarında, berilyumdan yapılmış el aletleri, vericilerde yüksek düzeyde mikrodalga gücü üretmek için kullanılan yüksek manyetik klistronları, magnetronları, yürüyen dalga tüplerini vb. ayarlamak için kullanılır. ⓘ
Nükleer uygulamalar
Berilyumdan ince plakalar veya folyolar bazen nükleer silah tasarımlarında termonükleer bombaların ilk aşamalarındaki plütonyum çukurlarının en dış katmanı olarak kullanılır ve bölünebilir malzemeyi çevreleyecek şekilde yerleştirilir. Bu berilyum katmanları plütonyum-239'un patlaması için iyi birer "itici" ve tıpkı berilyum moderatörlü nükleer reaktörlerde olduğu gibi iyi birer nötron yansıtıcıdır. ⓘ
Berilyum, nispeten az nötrona ihtiyaç duyulan laboratuvar cihazlarındaki bazı nötron kaynaklarında da yaygın olarak kullanılmaktadır (bir nükleer reaktör veya parçacık hızlandırıcı ile çalışan bir nötron jeneratörü kullanmak yerine). Bu amaçla, berilyum-9 hedefi polonyum-210, radyum-226, plütonyum-238 veya amerikyum-241 gibi bir radyoizotoptan gelen enerjik alfa parçacıklarıyla bombardıman edilir. Meydana gelen nükleer reaksiyonda, bir berilyum çekirdeği karbon-12'ye dönüşür ve alfa parçacığının gittiği yönle yaklaşık aynı yönde hareket eden bir serbest nötron yayılır. "Kestane" nötron başlatıcıları olarak adlandırılan bu tür alfa bozunumu güdümlü berilyum nötron kaynakları, bazı erken atom bombalarında kullanılmıştır. Berilyumun bir gama bozunumu radyoizotopundan gelen gama ışınlarıyla bombardıman edildiği nötron kaynakları da laboratuvar nötronları üretmek için kullanılır. ⓘ

Berilyum ayrıca CANDU reaktörleri için yakıt imalatında da kullanılmaktadır. Yakıt elemanları, sert lehim dolgu malzemesi olarak Be ile bir indüksiyon sert lehimleme işlemi kullanılarak yakıt kaplamasına direnç sert lehimlenen küçük uzantılara sahiptir. Yakıt demeti ile onu içeren basınç tüpü arasındaki teması önlemek için yatak pedleri yerlerine lehimlenir ve elemandan elemana teması önlemek için elemanlar arası ara pedler lehimlenir. ⓘ
Berilyum ayrıca Joint European Torus nükleer füzyon araştırma laboratuvarında da kullanılmaktadır ve daha gelişmiş ITER'de plazmaya bakan bileşenleri şartlandırmak için kullanılacaktır. Berilyum ayrıca mekanik, kimyasal ve nükleer özelliklerinin iyi kombinasyonu nedeniyle nükleer yakıt çubukları için bir kaplama malzemesi olarak önerilmiştir. Berilyum florür, sıvı florür toryum reaktörü (LFTR) de dahil olmak üzere birçok varsayımsal erimiş tuz reaktörü tasarımında çözücü, moderatör ve soğutucu olarak kullanılan ötektik tuz karışımı FLiBe'nin bileşen tuzlarından biridir. ⓘ
Akustik
Berilyumun düşük ağırlığı ve yüksek sertliği onu yüksek frekanslı hoparlör sürücüleri için kullanışlı bir malzeme haline getirmektedir. Berilyum pahalı (titanyumdan kat kat daha fazla), kırılganlığı nedeniyle şekillendirilmesi zor ve yanlış kullanıldığında zehirli olduğundan berilyum tweeter'lar üst düzey ev, profesyonel ses ve genel seslendirme uygulamalarıyla sınırlıdır. Bazı yüksek kaliteli ürünlerin hileli bir şekilde bu malzemeden yapıldığı iddia edilmiştir. ⓘ
Bazı üst düzey fonograf kartuşları, kütleyi azaltarak izlemeyi iyileştirmek için berilyum konsollar kullanmıştır. ⓘ
Elektronik
Berilyum, III-V bileşik yarı iletkenlerde p-tipi bir katkı maddesidir. Moleküler ışın epitaksisi (MBE) ile büyütülen GaAs, AlGaAs, InGaAs ve InAlAs gibi malzemelerde yaygın olarak kullanılır. Çapraz haddelenmiş berilyum levha, yüzeye montaj teknolojisinde baskılı devre kartları için mükemmel bir yapısal destektir. Kritik elektronik uygulamalarda, berilyum hem yapısal bir destek hem de ısı emicidir. Uygulama ayrıca alümina ve poliimid-cam alt tabakalarla iyi eşleşen bir termal genleşme katsayısı gerektirir. Berilyum-berilyum oksit kompozit "E-Malzemeler" bu elektronik uygulamalar için özel olarak tasarlanmıştır ve termal genleşme katsayısının çeşitli alt tabaka malzemelerine uyacak şekilde uyarlanabilmesi gibi ek bir avantaja sahiptir. ⓘ
Berilyum oksit, yüksek mukavemet ve sertlik ve çok yüksek erime noktası ile bir elektrik yalıtkanının ve mükemmel bir ısı iletkeninin birleşik özelliklerini gerektiren birçok uygulama için kullanışlıdır. Berilyum oksit, telekomünikasyon için radyo frekans vericilerindeki yüksek güçlü transistörlerde yalıtkan taban plakası olarak sıklıkla kullanılır. Berilyum oksit ayrıca uranyum dioksit nükleer yakıt peletlerinin termal iletkenliğini artırmada kullanılmak üzere incelenmektedir. Berilyum bileşikleri floresan aydınlatma tüplerinde kullanılmış, ancak tüpleri yapan işçilerde gelişen berilyoz hastalığı nedeniyle bu kullanım durdurulmuştur. ⓘ
Sağlık Hizmetleri
Berilyum, çeşitli dental alaşımların bir bileşenidir. ⓘ
İş güvenliği ve sağlığı
Berilyum işçiler için bir sağlık ve güvenlik sorunudur. İşyerinde berilyuma maruz kalmak, duyarlılık bağışıklık tepkisine yol açabilir ve zamanla kronik berilyum hastalığı (CBD) geliştirebilir. Amerika Birleşik Devletleri'ndeki Ulusal Mesleki Güvenlik ve Sağlık Enstitüsü (NIOSH), büyük bir berilyum ürünleri üreticisi ile işbirliği içinde bu etkileri araştırmaktadır. Bu araştırmanın amacı, çalışanlar için potansiyel bir risk oluşturabilecek iş süreçlerini ve maruziyetleri daha iyi anlayarak duyarlılaşmayı ve CBD'yi önlemek ve olumsuz sağlık etkileri riskini azaltacak etkili müdahaleler geliştirmektir. NIOSH ayrıca bu işbirliğinden bağımsız olarak hassasiyet ve CBD üzerine genetik araştırmalar yürütmektedir. NIOSH Analitik Yöntemler El Kitabı, berilyuma mesleki maruziyetleri ölçmek için yöntemler içerir. ⓘ
Önlemler
| Tehlikeler | |
|---|---|
| GHS etiketlemesi: | |
Piktogramlar
|
 
|
Sinyal kelimesi
|
Tehlike |
Tehlike bildirimleri
|
H301, H315, H317, H319, H330, H335, H350i, H372 |
Önlem ifadeleri
|
P201, P202, P280, P302, P304, P305+P351+P338, P310, P340, P352 |
| NFPA 704 (yangın elması) | |
Ortalama bir insan vücudunda yaklaşık 35 mikrogram berilyum bulunur ve bu miktar zararlı olarak kabul edilmez. Berilyum kimyasal olarak magnezyuma benzer ve bu nedenle onu enzimlerden uzaklaştırarak arızalanmalarına neden olabilir. Be2+ yüksek yüklü ve küçük bir iyon olduğundan, birçok doku ve hücreye kolayca girebilir, burada özellikle hücre çekirdeklerini hedef alır ve DNA sentezlemek için kullanılanlar da dahil olmak üzere birçok enzimi inhibe eder. Toksisitesi, vücudun berilyum seviyelerini kontrol etmek için hiçbir aracı olmaması ve vücuda girdikten sonra berilyumun çıkarılamaması nedeniyle daha da kötüleşir. Kronik berilyoz, berilyum ile kirlenmiş toz veya dumanların solunmasından kaynaklanan pulmoner ve sistemik granülomatöz bir hastalıktır; kısa bir süre içinde büyük miktarlarda veya uzun bir süre içinde küçük miktarlarda bu rahatsızlığa yol açabilir. Hastalığın belirtilerinin ortaya çıkması beş yıla kadar sürebilir; bu hastalığa yakalananların yaklaşık üçte biri ölür ve hayatta kalanlar sakat kalır. Uluslararası Kanser Araştırmaları Ajansı (IARC) berilyum ve berilyum bileşiklerini Kategori 1 kanserojen olarak listelemektedir. ABD'de Mesleki Güvenlik ve Sağlık İdaresi (OSHA), işyerinde izin verilen maruz kalma sınırını (PEL) zaman ağırlıklı ortalama (TWA) 2 µg/m3 ve 30 dakika boyunca 5 µg/m3 sabit maruz kalma sınırı ile maksimum 25 µg/m3 tepe sınırı olarak belirlemiştir. Ulusal Mesleki Güvenlik ve Sağlık Enstitüsü (NIOSH) tavsiye edilen maruz kalma sınırını (REL) sabit 500 ng/m3 olarak belirlemiştir. IDLH (yaşam ve sağlık için hemen tehlikeli) değeri 4 mg/m3'tür. Berilyumun toksisitesi arsenik ve cıva gibi diğer toksik metallerle aynı seviyededir. ⓘ
İnce bölünmüş berilyumun (toz veya toz, çoğunlukla berilyumun üretildiği veya işlendiği endüstriyel ortamlarda karşılaşılır) toksisitesi çok iyi belgelenmiştir. Katı berilyum metali havadan solunan tozla aynı tehlikeleri taşımaz, ancak fiziksel temasla ilişkili herhangi bir tehlike yeterince belgelenmemiştir. Bitmiş berilyum parçalarını taşıyan işçilere, hem önlem olarak hem de berilyum uygulamalarının çoğu olmasa da çoğu parmak izi gibi cilt teması kalıntılarını tolere edemediği için rutin olarak eldivenle tutmaları tavsiye edilir. ⓘ
Kimyasal pnömonit şeklindeki akut berilyum hastalığı ilk olarak 1933 yılında Avrupa'da ve 1943 yılında Amerika Birleşik Devletleri'nde rapor edilmiştir. Bir araştırma, 1949 yılında Amerika Birleşik Devletleri'nde floresan lamba üreten fabrikalardaki işçilerin yaklaşık %5'inde berilyuma bağlı akciğer hastalıkları olduğunu ortaya koymuştur. Kronik berilyoz birçok açıdan sarkoidoza benzemektedir ve ayırıcı tanısı genellikle zordur. Herbert L. Anderson gibi nükleer silah tasarımında çalışan bazı ilk işçileri öldürmüştür. ⓘ
Berilyum kömür cürufunda bulunabilir. Cüruf, sert yüzeylerdeki boya ve pası püskürtmek için aşındırıcı bir madde olarak formüle edildiğinde, berilyum havaya karışabilir ve bir maruziyet kaynağı haline gelebilir. ⓘ
İlk araştırmacılar berilyumun varlığını doğrulamak için berilyumu ve çeşitli bileşiklerini tatlandırmışlardır. Modern teşhis ekipmanları artık bu son derece riskli prosedürü gerektirmemektedir ve bu son derece toksik maddeyi yutmaya çalışılmamalıdır. Berilyum ve bileşikleri büyük bir dikkatle kullanılmalı ve berilyum tozunun açığa çıkmasına neden olabilecek herhangi bir faaliyet yürütülürken özel önlemler alınmalıdır (akciğer kanseri, berilyum yüklü toza uzun süre maruz kalmanın olası bir sonucudur). Floresan aydınlatma tüplerinde berilyum bileşiklerinin kullanımı 1949 yılında durdurulmuş olsa da, nükleer ve havacılık endüstrilerinde ve berilyum metalinin rafine edilmesi ve berilyum içeren alaşımların eritilmesi, elektronik cihazların üretimi ve diğer berilyum içeren malzemelerin taşınması sırasında berilyuma maruz kalma potansiyeli mevcuttur. ⓘ
Havada ve yüzeylerde berilyum için başarılı bir test yakın zamanda geliştirilmiş ve uluslararası gönüllü uzlaşma standardı ASTM D7202 olarak yayınlanmıştır. Prosedür, sülfonatlı hidroksibenzokinoline bağlı berilyum ile çözünme ve floresan tespiti için seyreltik amonyum biflorür kullanır ve işyerinde berilyum konsantrasyonu için önerilen sınırdan 100 kata kadar daha hassas tespit sağlar. Floresans, artan berilyum konsantrasyonu ile artar. Yeni prosedür çeşitli yüzeylerde başarıyla test edilmiştir ve refrakter berilyum oksit ve silisli berilyumun çözünmesi ve ultratrace tespiti için etkilidir (ASTM D7458). ⓘ
Atıf yapılan kaynaklar
- Emsley, John (2001). Doğanın Yapı Taşları: Elementler için A-Z Kılavuzu. Oxford, İngiltere, Birleşik Krallık: Oxford University Press. ISBN 978-0-19-850340-8.
- Mackay, Kenneth Malcolm; Mackay, Rosemary Ann; Henderson, W. (2002). Modern inorganik kimyaya giriş (6. baskı). CRC Press. ISBN 978-0-7487-6420-4.
- Weeks, Mary Elvira; Leichester, Henry M. (1968). Elementlerin Keşfi. Easton, PA: Journal of Chemical Education. LCCCN 68-15217. ⓘ
Bileşikleri
Bileşikleri genellikle renksizdir. Çözelti, kuru toz ya da buhar halinde çözünür, bileşikleri ise zehirlidir. ⓘ
İzotoplar
Berilyumun doğada bulunan tek kararlı izotopu berilyum-9'dur. Yarı ömrü 3.000.000 yıl olan berilyum-10 ve 10−15 saniyeden daha kısa sürede kendiliğinden iki alfa parçacığına bölünen berilyum-8 gibi yapay izotopları da üretilmiştir. ⓘ
![{\displaystyle {\ce {[Be(H_2O)_4]^{2+}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8c300bc0a3682a741d256b1a6a8dcb246a855239)
![{\displaystyle {\ce {[Be_3O(H_2PO_4)_6]^{2-}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4a5d9b088328a7ec7a57f65641f44ab8eab4e152)

![{\displaystyle {\ce {H_{2}A{+}[Be(H_{2}O)_{4}]^{2+}\leftrightharpoons [BeA(H_{2}O)_{2}]{+}2H^{+}{+}2H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/88afd13645c1b2eca86d7ba9ba8586abca494284)
![{\displaystyle {\ce {H_{2}A{+}[BeA(H_{2}O)_{2}]\leftrightharpoons [BeA_{2}]^{2-}{+}2H^{+}{+}2H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a36992a15f44668eff511201715607bfbbfcdfaa)
![{\displaystyle {\ce {Na_4[Be_6(OCH_2(O)O)_6]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eb11d9d4fdbfc6972b29c3f0da2932c7af31f59a)

