Alkol


Kimyada alkol, doymuş bir karbon atomuna bağlı en az bir hidroksil fonksiyonel grubu (-OH) taşıyan bir organik bileşik türüdür. Alkol terimi başlangıçta, ilaç olarak kullanılan ve alkollü içeceklerde bulunan ana alkol olan birincil alkol etanolü (etil alkol) ifade eder. Metanol ve etanolün en basit üyeleri olduğu önemli bir alkol sınıfı, genel formülü CnH2n+1OH olan tüm bileşikleri içerir. Bu makalenin konusu olan basit monoalkoller birincil (RCH2OH), ikincil (R2CHOH) ve üçüncül (R3COH) alkolleri içerir. ⓘ
Hidroksil grubunun en yüksek önceliğe sahip fonksiyonel grup olduğu tüm maddelerin IUPAC kimyasal adında -ol son eki görünür. Bileşikte daha yüksek öncelikli bir grup bulunduğunda, IUPAC adında hidroksi- ön eki kullanılır. IUPAC dışı isimlerdeki (parasetamol veya kolesterol gibi) -ol son eki de tipik olarak maddenin bir alkol olduğunu gösterir. Bununla birlikte, hidroksil fonksiyonel grupları içeren birçok maddenin (özellikle glikoz ve sükroz gibi şekerler) ne -ol son ekini ne de hidroksi- ön ekini içeren isimleri vardır. ⓘ
Tarihçe
Şarap ekshalasyonlarının yanıcı doğası Aristoteles (MÖ 384-322), Theophrastus (MÖ 371-287) ve Yaşlı Pliny (MS 23/24-79) gibi antik doğa filozofları tarafından zaten biliniyordu. Ancak bu durum, ikinci ve üçüncü yüzyıl Roma Mısır'ında daha gelişmiş damıtma tekniklerinin geliştirilmesine rağmen alkolün hemen izole edilmesine yol açmamıştır. İlk olarak Cābir ibn Ḥayyān'a (MS dokuzuncu yüzyıl) atfedilen yazılardan birinde bulunan önemli bir tanıma göre, kaynayan şaraba tuz eklenerek şarabın nispi uçuculuğu arttırılır ve ortaya çıkan buharların yanıcılığı arttırılabilir. Şarabın damıtılması Kindî'ye (MS 801-873) ve Fârâbî'ye (MS 872-950) atfedilen Arapça eserlerde ve Zehrâvî'nin (Latince: Abulcasis, 936-1013) Kitâbü't-Tasrîf'inin (daha sonra Liber servatoris olarak Latinceye çevrilmiştir) 28. kitabında yer almaktadır. On ikinci yüzyılda, şarabın tuzla damıtılması yoluyla aqua ardens ("yanan su", yani alkol) üretimine ilişkin tarifler bir dizi Latince eserde yer almaya başlamış ve on üçüncü yüzyılın sonunda Batı Avrupalı kimyagerler arasında yaygın olarak bilinen bir madde haline gelmiştir. ⓘ
Taddeo Alderotti'nin (1223-1296) eserleri, alkolün konsantre edilmesi için su soğutmalı bir imbikten tekrarlanan fraksiyonel damıtmayı içeren ve %90 saflıkta alkol elde edilebilen bir yöntemi tanımlamaktadır. Etanolün tıbbi özellikleri Villanova'lı Arnald (MS 1240-1311) ve Rupescissa'lı John (yak. 1310-1366) tarafından incelenmiş, ikincisi onu tüm hastalıkları önleyebilen yaşam koruyucu bir madde olarak görmüştür (aqua vitae veya "yaşam suyu", John tarafından şarabın özü olarak da adlandırılmıştır). ⓘ
İsimlendirme
Etimoloji
"Alkol" kelimesi Arapça kohl (Arapça: الكحل, romanize: al-kuḥl), göz kalemi olarak kullanılan bir pudradan gelmektedir. Al- Arapça kesin artikeldir, İngilizce'deki the'ye eşdeğerdir. Alkol ilk olarak doğal mineral stibnitin antimon trisülfür Sb2S3 oluşturmak üzere süblimleştirilmesiyle üretilen çok ince toz için kullanılmıştır. Bu mineralin özü veya "ruhu" olduğu düşünülüyordu. Antiseptik, göz kalemi ve kozmetik olarak kullanılmıştır. Alkolün anlamı genel olarak damıtılmış maddelere genişletildi ve daha sonra "alkollü içki" sert likör ile eşanlamlı olduğunda etanol ile daraltıldı. ⓘ
Bartholomew Traheron, John of Vigo'nun 1543 tarihli çevirisinde, kelimeyi "barbar" yazarlar tarafından "ince toz" için kullanılan bir terim olarak tanıtmaktadır. Vigo şöyle yazmıştır: "barbar yazarlar alkolü ya da (bazılarının söylediği gibi) alcofoll'u en ince toz için kullanırlar." ⓘ
William Johnson'ın 1657 tarihli Lexicon Chymicum'u kelimeyi "antimonium sive stibium" olarak açıklamaktadır. Sözcük, şarabın damıtılmış özü olan "şarap alkolü" de dahil olmak üzere damıtma yoluyla elde edilen herhangi bir sıvıya atıfta bulunmaya başlamıştır. Libavius Alchymia'da (1594) "vini alcohol vel vinum alcalisatum "dan söz eder. Johnson (1657) alkol vini'yi "quando omnis superfluitas vini a vino separatur, ita ut accensum ardeat donec totum consumatur, nihilque fæcum aut phlegmatis in fundo remaneat" olarak açıklar. Kelimenin anlamı 18. yüzyılda "şarap ruhu" (bugün etanol olarak bilinen kimyasal) ile sınırlandırılmış ve 1850'den sonra modern kimyada "alkoller" olarak adlandırılan maddeler sınıfına genişletilmiştir. ⓘ
Etanol terimi 1892 yılında "etan" ile "alkol" kelimesinin "-ol" eki harmanlanarak icat edilmiş ve bir libfix olarak genelleştirilmiştir. ⓘ
Sistematik isimler
IUPAC isimlendirmesi, bilimsel yayınlarda ve maddenin kesin olarak tanımlanmasının önemli olduğu durumlarda, özellikle de molekülün göreceli karmaşıklığının böyle bir sistematik ismi kullanışsız hale getirmediği durumlarda kullanılır. Basit alkollerin adlandırılmasında, alkan zincirinin adı terminal e'yi kaybeder ve -ol son ekini ekler, örneğin alkan zinciri adı "etan" dan "etanol" de olduğu gibi. Gerektiğinde, hidroksil grubunun konumu alkan adı ve -ol arasında bir sayı ile belirtilir: CH3CH2CH2OH için propan-1-ol, CH3CH(OH)CH3 için propan-2-ol. Daha yüksek öncelikli bir grup mevcutsa (aldehit, keton veya karboksilik asit gibi), hidroksi-ön eki kullanılır, örneğin 1-hidroksi-2-propanon (CH3C(O)CH2OH). ⓘ
| CH3-CH2-CH2-OH | 
|

|

|

|

|

|

|
||
| n-propil alkol, propan-1-ol, veya 1-propanol |
izopropil alkol, propan-2-ol, veya 2-propanol |
siklohekzanol | izobütil alkol, 2-metilpropan-1-ol, veya 2-metil-1-propanol |
tert-amil alkol, 2-metilbutan-2-ol veya 2-metil-2-bütanol |
| Birincil alkol | İkincil bir alkol | İkincil bir alkol | Birincil alkol | Üçüncül bir alkol |
Hidroksi grubunun aromatik bir halka üzerindeki bir sp2 karbonuna bağlı olduğu durumlarda, molekül fenol olarak ayrıca sınıflandırılır ve fenollerin adlandırılması için IUPAC kuralları kullanılarak adlandırılır. Fenoller farklı özelliklere sahiptir ve alkol olarak sınıflandırılmazlar. ⓘ
İki tane yapı izomeri vardır; n-propanol ve izopropanol. n-propanol, CH3-CH2-CH2-OH hoş kokulu, renksiz, 97.2 derecede kaynayan bir sıvıdır. Metanol sentezi yanında bir yan ürün olarak ve füzel yağı içinde bulunur. Ticari olarak oxo prosesi denilen işlemle hazırlanır. İzopropanol, (CH3)2-CH-OH, 82.4 derecede kaynayan renksiz bir sıvıdır. Asetonun katalitik hidrojenasyonu ile elde edilebilir: Ticari olarak propenin sülfürik asit içinde tutulması ve bunu müteakip meydana gelen esterin hidrolizi ile elde edilir. ⓘ
Propanol ve izopropanol çözücü olarak sık kullanılır. . ⓘ
Yaygın isimler
Diğer daha az resmi bağlamlarda, bir alkol genellikle ilgili alkil grubunun adıyla ve ardından "alkol" kelimesiyle adlandırılır, örneğin metil alkol, etil alkol. Propil alkol, hidroksil grubunun düz propan zinciri üzerindeki uç veya orta karbona bağlanmasına bağlı olarak n-propil alkol veya izopropil alkol olabilir. Sistematik adlandırma altında açıklandığı gibi, molekül üzerindeki başka bir grup öncelikli ise, alkol kısmı genellikle "hidroksi-" ön eki kullanılarak belirtilir. ⓘ
Alkoller daha sonra hidroksil fonksiyonel grubunu taşıyan karbon atomuna bağlı karbon atomlarının sayısına göre birincil, ikincil (sec-, s-) ve üçüncül (tert-, t-) olarak sınıflandırılır. (İlgili sayısal kısaltmalar 1°, 2° ve 3° bazen resmi olmayan ortamlarda da kullanılır). Birincil alkollerin genel formülleri RCH2OH'dir. En basit birincil alkol, R=H olan metanol (CH3OH) ve bir sonraki R=CH3, metil grubu olan etanoldür. İkincil alkoller, en basiti 2-propanol (R=R'=CH3) olan RR'CHOH formunda olanlardır. Üçüncül alkoller için genel form RR'R "COH'dir. En basit örnek tert-butanol (2-metilpropan-2-ol) olup, bunun için R, R' ve R" her biri CH3'tür. Bu kısaltmalarda R, R' ve R" sübstitüentleri, alkil veya diğer bağlı, genellikle organik grupları temsil eder. ⓘ
Arkaik isimlendirmede, alkoller son olarak "-karbinol" kullanılarak metanol türevleri olarak adlandırılabilir. Örneğin, (CH3)3COH trimetilkarbinol olarak adlandırılabilir. ⓘ
| Tip | Formül | IUPAC Adı | Ortak ad ⓘ |
|---|---|---|---|
| Monohidrik alkoller |
CH3OH | Metanol | Ahşap alkol |
| C2H5OH | Etanol | Alkol | |
| C3H7OH | Propan-2-ol | İzopropil alkol, Sürtme alkolü | |
| C4H9OH | Bütan-1-ol | Butanol, Bütil alkol | |
| C5H11OH | Pentan-1-ol | Pentanol, Amil alkol | |
| C16H33OH | Hekzadekan-1-ol | Setil alkol | |
| Polihidrik alkoller |
C2H4(OH)2 | Etan-1,2-diol | Etilen glikol |
| C3H6(OH)2 | Propan-1,2-diol | Propilen glikol | |
| C3H5(OH)3 | Propan-1,2,3-triol | Gliserol | |
| C4H6(OH)4 | Bütan-1,2,3,4-tetraol | Eritritol, Treitol | |
| C5H7(OH)5 | Pentane-1,2,3,4,5-pentol | Ksilitol | |
| C6H8(OH)6 | hexane-1,2,3,4,5,6-hexol | Mannitol, Sorbitol | |
| C7H9(OH)7 | Heptane-1,2,3,4,5,6,7-heptol | Volemitol | |
| Doymamış alifatik alkoller |
C3H5OH | Prop-2-ene-1-ol | Alil alkol |
| C10H17OH | 3,7-Dimethylocta-2,6-dien-1-ol | Geraniol | |
| C3H3OH | Prop-2-yn-1-ol | Propargil alkol | |
| Alisiklik alkoller | C6H6(OH)6 | Siklohekzan-1,2,3,4,5,6-hekzol | İnositol |
| C10H19OH | 5-Metil-2-(propan-2-il)siklohekzan-1-ol | Mentol |
Uygulamalar

Alkoller sayısız kullanım alanıyla uzun bir geçmişe sahiptir. Bu makalenin odak noktası olan basit mono-alkoller için aşağıdakiler en önemli endüstriyel alkollerdir:
- metanol, özellikle formaldehit üretimi için ve yakıt katkı maddesi olarak
- etanol, özellikle alkollü içecekler, yakıt katkısı, çözücü
- Çözücü ve çözücü öncüsü olarak kullanım için 1-propanol, 1-butanol ve izobütil alkol
- Plastikleştirici olarak kullanılan C6-C11 alkolleri, örneğin polivinilklorür
- yağlı alkol (C12-C18), deterjan öncülleri
Metanol, 1980 yılında üretilen yaklaşık 12 milyon ton/yıl ile en yaygın endüstriyel alkoldür. Diğer alkollerin toplam kapasitesi yaklaşık olarak aynıdır ve kabaca eşit olarak dağılmıştır. ⓘ
Zehirlilik
Akut toksisite açısından, basit alkoller düşük akut toksisiteye sahiptir. Birkaç mililitrelik dozlar tolere edilir. Pentanoller, heksanoller, oktanoller ve daha uzun alkoller için LD50 2-5 g/kg (sıçanlar, oral) arasında değişir. Metanol ve etanol daha az akut toksiktir. Tüm alkoller hafif cilt tahriş edicidir. ⓘ
Metanolün (ve etilen glikolün) metabolizması, karaciğer alkol dehidrojenazı için daha yüksek bir afiniteye sahip olan etanolün varlığından etkilenir. Bu şekilde metanol idrarla bozulmadan atılır. ⓘ
Fiziksel özellikler
Genel olarak, hidroksil grubu alkolleri polar hale getirir. Bu gruplar birbirleriyle ve diğer birçok bileşikle hidrojen bağları oluşturabilir. Polar OH'nin varlığı nedeniyle alkoller basit hidrokarbonlardan daha fazla suda çözünürler. Metanol, etanol ve propanol suda karışabilir. Dört karbonlu bir zincire sahip olan bütanol orta derecede çözünür. ⓘ
Hidrojen bağı nedeniyle, alkoller benzer hidrokarbonlar ve eterlerden daha yüksek kaynama noktasına sahip olma eğilimindedir. Alkol etanolün kaynama noktası 78,29 °C iken, hidrokarbon hekzan için 69 °C ve dietil eter için 34,6 °C'dir. ⓘ
Doğada Bulunuşu
Basit alkoller doğada yaygın olarak bulunur. Etanol en belirgin olanıdır çünkü önemli bir enerji üretim yolu olan fermantasyonun ürünüdür. Başta fusel alkoller olmak üzere diğer basit alkoller sadece eser miktarda oluşur. Ancak daha karmaşık alkoller, şekerlerde, bazı amino asitlerde ve yağ asitlerinde görüldüğü gibi yaygındır. ⓘ
Üretim
Ziegler ve okso prosesleri
Ziegler prosesinde, lineer alkoller etilen ve trietilalüminyumdan üretilir ve bunu oksidasyon ve hidroliz takip eder. İdealize edilmiş bir 1-oktanol sentezi gösterilmiştir:
- Al(C2H5)3 + 9 C2H4 → Al(C8H17)3
- Al(C8H17)3 + 3 O + 3 H2O → 3 HOC8H17 + Al(OH)3 ⓘ
Proses, distilasyonla ayrılan bir dizi alkol üretir. ⓘ
Birçok yüksek alkol, alkenlerin hidroformilasyonu ve ardından hidrojenasyon ile üretilir. Yaygın olduğu gibi bir terminal alkene uygulandığında, tipik olarak doğrusal bir alkol elde edilir:
- RCH=CH2 + H2 + CO → RCH2CH2CHO
- RCH2CH2CHO + 3 H2 → RCH2CH2CH2OH ⓘ
Bu tür işlemler, deterjanlar için yararlı olan yağ alkolleri verir. ⓘ
Hidrasyon reaksiyonları
Endüstriyel öneme sahip bazı düşük molekül ağırlıklı alkoller, alkenlere su eklenmesiyle üretilir. Etanol, izopropanol, 2-butanol ve tert-butanol bu genel yöntemle üretilir. Doğrudan ve dolaylı yöntemler olmak üzere iki uygulama kullanılmaktadır. Doğrudan yöntem, tipik olarak asit katalizörleri kullanarak kararlı ara ürünlerin oluşumunu önler. Dolaylı yöntemde, alken sülfat estere dönüştürülür ve bu da daha sonra hidrolize edilir. Etilen (etilen hidrasyonu) veya damıtılmış ham petrol fraksiyonlarının kırılmasından elde edilen diğer alkenler kullanılarak doğrudan hidrasyon. ⓘ
Hidrasyon endüstriyel olarak etilen oksitten diol etilen glikol üretmek için de kullanılır. ⓘ
Biyolojik yollar
Etanol, maya varlığında ve 37 °C'den düşük sıcaklıkta nişastanın hidrolizinden elde edilen şekerden üretilen glikoz kullanılarak fermantasyon yoluyla etanol elde edilir. Örneğin, böyle bir süreç sükrozun invertaz enzimi tarafından glukoz ve fruktoza dönüştürülmesi, ardından glukozun zimaz enzim kompleksi tarafından etanol ve karbondioksite dönüştürülmesi şeklinde ilerleyebilir. ⓘ
Bağırsaktaki iyi huylu bakterilerin birkaç türü fermantasyonu bir anaerobik metabolizma biçimi olarak kullanır. Bu metabolik reaksiyon atık ürün olarak etanol üretir. Dolayısıyla, insan vücudu bu bakteriler tarafından endojen olarak üretilen bir miktar alkol içerir. Nadir durumlarda bu, sarhoş edici miktarlarda alkolün üretildiği "otomatik bira sendromuna" neden olmak için yeterli olabilir. ⓘ
Etanol gibi bütanol de fermantasyon süreçleri ile üretilebilir. Saccharomyces mayasının 75 °F (24 °C) üzerindeki sıcaklıklarda bu yüksek alkolleri ürettiği bilinmektedir. Clostridium acetobutylicum bakterisi selülozla beslenerek endüstriyel ölçekte bütanol üretebilir. ⓘ
İkame
Birincil alkil halojenürler sulu NaOH veya KOH ile nükleofilik alifatik sübstitüsyonda esas olarak birincil alkollerle reaksiyona girer. (İkincil ve özellikle üçüncül alkil halojenürler bunun yerine eliminasyon (alken) ürünü verecektir). Grignard reaktifleri karbonil grupları ile reaksiyona girerek ikincil ve üçüncül alkollere dönüşür. İlgili reaksiyonlar Barbier reaksiyonu ve Nozaki-Hiyama reaksiyonudur. ⓘ
İndirgeme
Aldehitler veya ketonlar sodyum borohidrit veya lityum alüminyum hidrit ile indirgenir (asidik bir işlemden sonra). Alüminyumizopropilatlar ile yapılan bir diğer indirgeme Meerwein-Ponndorf-Verley indirgemesidir. Noyori asimetrik hidrojenasyonu, β-keto-esterlerin asimetrik indirgenmesidir. ⓘ
Aldehitlerin indirgenmesiyle primer alkol, ketonların indirgenmesiyle sekonder alkol elde edilir. Tersiyer alkoller indirgenme ile elde edilemez. ⓘ
Hidroliz
Alkenler, genellikle ikincil veya üçüncül alkoller veren bir katalizör olarak konsantre sülfürik asit kullanılarak asit katalizli bir hidrasyon reaksiyonuna girer. Alkenlerin hidroborasyon-oksidasyonu ve oksimerkürasyon-redüksiyonu organik sentezlerde daha güvenilirdir. Alkenler, halohidrin oluşum reaksiyonunda NBS ve su ile reaksiyona girer. Aminler diazonyum tuzlarına dönüştürülebilir ve bunlar daha sonra hidrolize edilir. ⓘ
İndirgeme ve hidrasyon yoluyla ikincil bir alkol oluşumu gösterilmiştir:
Tepkiler
- Alkoller hidrojen halojenürlerle yer değiştirme tepkimesi verir.
- Karboksilik asitlerle kondenzasyon tepkimesi sonucu ester oluşur.
- Alkollerden ayrılma tepkimesiyle su çekilerek eter oluşur.
- Primer alkoller bir basamak yükseltgendiğinde aldehit, sekonder alkoller yükseltgendiğinde ise keton oluşur. ⓘ
Deprotonasyon
Sulu pKa değerleri 16-19 civarında olan bu asitler, genel olarak sudan biraz daha zayıf asitlerdir. Sodyum hidrür veya sodyum gibi güçlü bazlarla, genel formülü RO- M+ olan alkoksitler adı verilen tuzlar oluştururlar.
- 2 R-OH + 2 NaH → 2 R-O-Na+ + 2 H2
- 2 R-OH + 2 Na → 2 R-O-Na+ + H2 ⓘ
Alkollerin asitliği solvasyondan güçlü bir şekilde etkilenir. Gaz fazında alkoller suya göre daha asidiktir. DMSO'da alkoller (ve su) yaklaşık 29-32 pKa değerine sahiptir. Sonuç olarak, alkoksitler (ve hidroksit) bu çözücüde güçlü bazlar ve nükleofillerdir (örneğin, Williamson eter sentezi için). Özellikle, DMSO içindeki RO- veya HO-, alkinlerin deprotonasyonu yoluyla asetilid iyonlarının önemli denge konsantrasyonlarını oluşturmak için kullanılabilir (bkz. Favorskii reaksiyonu). ⓘ
Nükleofilik sübstitüsyon
OH grubu nükleofilik sübstitüsyon reaksiyonlarında iyi bir ayrılma grubu değildir, bu nedenle nötr alkoller bu tür reaksiyonlarda reaksiyona girmez. Bununla birlikte, oksijen ilk önce R-OH+2 vermek üzere protonlanırsa, ayrılan grup (su) çok daha kararlıdır ve nükleofilik sübstitüsyon gerçekleşebilir. Örneğin, tersiyer alkoller hidroklorik asitle reaksiyona girerek tersiyer alkil halojenürler üretir; burada hidroksil grubu tek moleküler nükleofilik sübstitüsyonla bir klor atomuyla yer değiştirir. Birincil veya ikincil alkoller hidroklorik asit ile reaksiyona sokulacaksa, çinko klorür gibi bir aktivatöre ihtiyaç vardır. Alternatif olarak, dönüşüm doğrudan tiyonil klorür kullanılarak da gerçekleştirilebilir[1]. ⓘ
Alkoller de aynı şekilde, örneğin hidrobromik asit veya fosfor tribromür kullanılarak alkil bromürlere dönüştürülebilir:
- 3 R-OH + PBr3 → 3 RBr + H3PO3 ⓘ
Barton-McCombie deoksijenasyonunda bir alkol, radikal ikame reaksiyonunda tribütiltin hidrür veya trimetilboran-su kompleksi ile bir alkana deoksijenlenir. ⓘ
Dehidrasyon
Bu arada, oksijen atomu, sülfürik asit gibi güçlü asitlerin varlığında onu zayıf bazik hale getiren yalnız çift bağlanmamış elektronlara sahiptir. Örneğin, metanol ile:
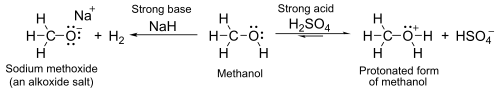
Güçlü asitlerle muamele edildikten sonra alkoller, alkenleri üretmek için E1 eliminasyon reaksiyonuna girer. Reaksiyon, genel olarak, en kararlı (genellikle en çok ikame edilmiş) alkenin oluştuğunu belirten Zaitsev Kuralına uyar. Üçüncül alkoller oda sıcaklığının hemen üzerinde kolayca elimine olur, ancak birincil alkoller daha yüksek bir sıcaklık gerektirir. ⓘ
Bu, etilen üretmek için etanolün asit katalizli dehidrasyonunun bir diyagramıdır:

Daha kontrollü bir eliminasyon reaksiyonu ksantat esterinin oluşumunu gerektirir. ⓘ
Protonoliz
Tersiyer alkoller güçlü asitlerle reaksiyona girerek karbokatyonlar oluşturur. Reaksiyon, tert-butil alkolden izobütilen gibi dehidrasyonlarıyla ilgilidir. Özel bir dehidrasyon reaksiyonu türü trifenilmetanol ve özellikle amin ikameli türevlerini içerir. Asitle muamele edildiğinde, bu alkoller su kaybederek ticari boyalar olan kararlı karbokatyonlar verir. ⓘ

Esterleştirme
Alkol ve karboksilik asitler Fischer esterifikasyonu olarak adlandırılan reaksiyona girer. Reaksiyon genellikle konsantre sülfürik asit gibi bir katalizör gerektirir:
- R-OH + R'-CO2H → R'-CO2R + H2O
Diğer ester türleri de benzer şekilde hazırlanır - örneğin, tosil (tosilat) esterleri, alkolün piridin içinde p-toluensülfonil klorür ile reaksiyona sokulmasıyla yapılır. ⓘ
Oksidasyon
Birincil alkoller (R-CH2OH) ya aldehitlere (R-CHO) ya da karboksilik asitlere (R-CO2H) oksitlenebilir. İkincil alkollerin (R1R2CH-OH) oksidasyonu normalde keton (R1R2C=O) aşamasında sonlanır. Tersiyer alkoller (R1R2R3C-OH) oksidasyona dirençlidir. ⓘ
Birincil alkollerin karboksilik asitlere doğrudan oksidasyonu normalde, karboksilik aside daha fazla oksitlenmeden önce su ile reaksiyona girerek bir aldehit hidrat (R-CH(OH)2) yoluyla dönüştürülen karşılık gelen aldehit yoluyla ilerler. ⓘ

Birincil alkollerin aldehitlere dönüşümü için yararlı olan reaktifler normalde ikincil alkollerin ketonlara oksidasyonu için de uygundur. Bunlar Collins reaktifi ve Dess-Martin periodinanı içerir. Birincil alkollerin karboksilik asitlere doğrudan oksidasyonu potasyum permanganat veya Jones reaktifi kullanılarak gerçekleştirilebilir. ⓘ
Ayrıca bakınız
- Enol
- Etanol yakıt
- Yağlı alkol
- Alkolle ilgili makaleler dizini
- Alkollerin listesi
- Lucas testi
- Poliol
- Sürtme alkolü
- Şeker alkolü
- Transesterifikasyon ⓘ
Genel referanslar
- Metcalf, Allan A. (1999). The World in So Many Words. Houghton Mifflin. ISBN 0-395-95920-9. ⓘ
Etimoloji
Türkçeye Fransızca alcool sözcüğünden geçen alkolün kökeni Arapça al-kuhl (kara toz) sözcüğüdür. Arapçada kuhl denen madde sürme yapımında kullanılan antimon sülfat ve kurşun sülfattır. ⓘ
Kimyasal yapılarına göre alkoller
Alifatik alkoller
Metil alkol (Metanol, Karbinol): CH3OH
Elde edilişi: Metanol ilk defa 1661’de odunun kuru kuruya damıtılmasıyla elde edildi. Damıtma ürününde % 1,5-3 metanol, % 10 asetik asit, % 0,5 aseton ve başkaları bulunmaktadır. ⓘ
Endüstride, karbonmonoksit ile hidrojenin reaksiyonundan elde edilir. ⓘ
Bu metodla saf metanol elde edilirse de sıcaklığın 30-40 derece yükselmesi halinde n- propanol ve izobütanol teşekkül edebilir. ⓘ
Özellikleri : Saf metanol 64,6 derecede kaynayan akışkan bir sıvı olup, parlak olmayan mavimsi bir alevle yanar. Bütün organik çözücülerde her oranda çözünür. Fraksiyonlu destilasyonla sulu çözeltisinden % 99’luk bir saflıkta elde edilir. Susuz (mutlak) metanol elde etmek için Mg kullanılır: 2 CH3OH + Mg → (CH3O)2Mg + H2 ⓘ
(CH3O)2Mg + H2O → 2C H3OH + MgO ⓘ
Çok az miktardaki metanol canlı organizma için zehirdir. Kalıcı yaralar, bozukluklar meydana getirir. Örneğin 25 gram metanol içilirse gözler kör olur. ⓘ
Kullanılışı: Endüstride çözücü ve motor yakıtlarının bir bileşeni olarak geniş çapta kullanılır. Formaldehit ve anilin boyalarının elde edilişinde kullanılır. Ayrıca metillendirme vasıtası olarak organik sentezlerde ve tıbbi ve endüstriyel alkolün içilmezliğini sağlamada yaygın olarak kullanılır. ⓘ
Etil alkol (Etanol) C2H5OH
Vücutta metabolize olabilen tek alkol türüdür. ayrıca Metil alkol zehirlenmelerinde panzehir olarak kullanılır. (Etil alkol, alkolu metabolize eden enzimleri meşgul ederek bu süre içinde metil alkolün vücuttan uzaklaşmasını sağlar. çünkü Vücuda asıl zehirli olup atılamayan ürün metil alkol değil, vücutta metil alkolden oluşan formaldehittir. Oysa etil alkolden oluşan asetaldehit vücuttaki aldehit dehidrojenaz enzimi tarafından metabolize edilip atılır. Sanayide üretilmiş olan ilk arabaların çalışmasında etil alkol kullanılmıştır. Sanayideki etil alkolün üretimi etan gazının sülfürik asit eşliğinde suyun içinde çözülmesiyledir.
CH2=CH2+H2O → CH3-CH2-OH ⓘ
Poli alkoller
Bu sınıf bileşikleri temsil eden en basit örnekler, dihidrik alkol (etilen glikol), trihidrik alkol (gliserin) ve tetrahidrik alkol (eritritol)dür: CH2OH-CH2OH (Etilen glikol) ⓘ
CH2OH-CHOH-CH2-OH (Gliserin) ⓘ
CH2OH-CHOH-CHOH-CH2OH (Eritritol) ⓘ
Bu bileşiklerin hidroksil grubu arttıkça eter ve alkoldeki çözünürlükleri artar. Polialkollerin bazısı kıymetli tabii ürünlerin birer bileşenidir. Mesela gliserin yağlarda bulunur. Daha yüksek polialkoller mesela pentiol ve hexitoller karbonhidratlar kimyasında önemli yer tutar. ⓘ
Etilen glikol
Elde edilişi:
- Mono alkollere benzer olarak 1, 2 dihalojen alkanlardan sulu potasyum hidroksit veya alkol metal karbonat yardımıyla hidrolizle elde edilebilir. Misal 1, 2 - dibromoetan etilenglikol verir.
- Etilen glikol endüstriyel olarak etilenden aşağıdaki metotlarla elde edilir.
Özellikleri: Etilenglikol renksiz, kaynama noktası 198 derece olan vizkoz (kıvamlı) tatlımsı bir yağdır. Su ve alkolde her oranda karışır, 1, 2 - glikollerin kimyasal özellikleri mono alkollerinkine benzer. Etilen glikolün biraz derişik sülfürik asitle veya derişik fosforik asitle ısıtılmasıyla kıymetli bir çözücü olan dioksan elde edilir. ⓘ
Kullanılışı: Etilen glikol, onun monometil eteri, monoetil eteri ve dioksan kıymetli çözücüdürler. (Misal, vernikler ve selüloz asetatlar için.) Etilen glikol antifriz olarak, gliserin yerine sık sık kullanılır. ⓘ
Aromatik alkoller
Aromatik alkoller yan zincirde OH- grubu bulundurduğundan aril grubu ve alifatik alkol grubu bileşiği gibi düşünülebilirler. Misal: Fenil metanol, C6H5-CH2OH, renksiz, hoş kokulu bir sıvı olup KN. 205 ° dir. Suda az çözünür. Elde ediliş reaksiyonu aşağıdaki gibi gösterilebilir. ⓘ
C6H5-CH2Cl+Na2CO3+H2O ® C6H5-CH2 OH+NaHCO3+NaCl ⓘ
Fenil etanol, C6H5-CH2-CH2OH, gül yağının en fazla olan bileşeni olup, esterleri parfümeride çok kullanılır. ⓘ
Adlandırılmaları
- Hidroksi grubunun bağlı olduğu en uzun karbon zinciri seçilir. Bu zincire karşılık gelen alkan adının sonuna -ol eki getirilir.
- Hidroksinin bağlı olduğu karbona en küçük numara gelecek şekilde karbonlar numaralandırılır.
- Hidroksi grubunun bağlı olduğu karbonun numarası alkolün adının önüne yazılır.
- Alkol bir polialkolse hidroksi sayısını gösteren ön ek, -ol ekinin önüne getirilir. (diol, triol gibi) ⓘ
Elde edilişleri
Alkenlere su katılması
Asit katalizörlüğünde alkenlere su katılır. Örneğin etene su katılmasıyla etanol oluşur. ⓘ
Fiziksel özellikleri
- Alkoller yapılarında bulunan -OH hidrofil grubu sayesinde suda çözünür. Yine -OH grubu sayesinde hidrojen bağı oluşturur.
- Karbon sayısı arttıkça hidrofob grubun baskınlığı artacağından sudaki çözünürlük azalır.
- Karbon sayısı ve -OH grubu sayısı arttıkça kaynama noktası da artar. Ancak dallanmalar arttıkça kaynama noktası düşer. ⓘ


