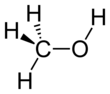
Metanol
|
| |||
|
| |||

| |||
| İsimler | |||
|---|---|---|---|
| Telaffuz | /ˈmɛθənɒl/ | ||
| Tercih edilen IUPAC adı
Metanol | |||
| Diğer isimler
Karbinol
Kolombiyalı içkiler Hidroksimetan MeOH Metil alkol Metil hidroksit Metilik alkol Metilol Metilen hidrat, birincil alkol Pyroligneous ruhu Ahşap alkol Odun naftası Ahşap ruhu | |||
| Tanımlayıcılar | |||
CAS Numarası
|
|||
3D model (JSmol)
|
|||
| 3DMet | |||
Beilstein Referans
|
1098229 | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| EC Numarası |
| ||
Gmelin Referans
|
449 | ||
| KEGG | |||
| MeSH | Metanol | ||
PubChem CID
|
|||
| RTECS numarası |
| ||
| UNII | |||
| BM numarası | 1230 | ||
InChI
| |||
GÜLÜMSEMELER
| |||
| Özellikler | |||
Kimyasal formül
|
CH 3OH veya CH 4O | ||
| Molar kütle | 32,04 g mol-1 | ||
| Görünüş | Renksiz sıvı | ||
| Koku | Tatlı ve keskin | ||
| Yoğunluk | 0,792 g/cm3 | ||
| Erime noktası | -97,6 °C (-143,7 °F; 175,6 K) | ||
| Kaynama noktası | 64,7 °C (148,5 °F; 337,8 K) | ||
Suda çözünürlük
|
karışabilir | ||
| log P | −0.69 | ||
| Buhar basıncı | 13,02 kPa (20 °C'de) | ||
| Asitlik (pKa) | 15.5 | ||
| Konjugat asit | Metiloksonyum | ||
| Konjugat baz | Metanolat | ||
Manyetik duyarlılık (χ)
|
-21,40-10-6 cm3/mol | ||
Kırılma indisi (nD)
|
1.33141 | ||
| Viskozite | 0,545 mPa-s (25 °C'de) | ||
Dipol moment
|
1.69 D | ||
| Termokimya | |||
Yanma ısısı, yüksek değer (HHV)
|
725,7 kJ/mol, 173,4 kcal/mol, 5,77 kcal/g | ||
| Tehlikeler | |||
| İş güvenliği ve sağlığı (OHS/OSH): | |||
Ana tehlikeler
|
Metanol ve buharları yanıcıdır.
Küçük hayvanlar için orta derecede toksik - Büyük hayvanlar ve insanlar için yüksek derecede toksik (yüksek konsantrasyonlarda) - Yutulması halinde ölümcül olabilir veya körlüğe ve karaciğer, böbrekler ve kalpte hasara neden olabilir - Tekrarlanan aşırı maruziyetten kaynaklanan toksisite etkileri, merkezi sinir sistemi, özellikle optik sinir üzerinde birikici bir etkiye sahiptir - Belirtiler gecikebilir, 12 ila 18 saat sonra şiddetli hale gelebilir ve maruziyetten sonra birkaç gün sürebilir | ||
| GHS etiketlemesi: | |||
Piktogramlar
|
  
| ||
Sinyal kelimesi
|
Tehlike | ||
Tehlike bildirimleri
|
H225, H301, H302, H305, H311, H331, H370 | ||
Önlem ifadeleri
|
P210, P233, P235, P240, P241, P242, P243, P260, P264, P270, P271, P280, P301+P330+P331, P302+P352, P303+P361+P353, P304+P340, P305+P351+P338, P307+P311, P310, P311, P312, P337+P313, P361, P363, P370+P378, P403+P233, P405, P501 | ||
| NFPA 704 (yangın elması) | |||
| Parlama noktası | 11 ila 12 °C (52 ila 54 °F; 284 ila 285 K) | ||
Otomatik ateşleme
sıcaklık |
470 °C (878 °F; 743 K) 385 °C (725 °F; 658 K) | ||
| Patlayıcı limitleri | 6–36% | ||
| Öldürücü doz veya konsantrasyon (LD, LC): | |||
LD50 (medyan doz)
|
58 mg/kg (sıçan, oral) 730 mg/kg (fare, oral) 1280 mg/kg (sıçan, oral) 1400 mg/kg (tavşan, oral) | ||
LC50 (medyan konsantrasyon)
|
64.000 ppm (sıçan, 4 saat) | ||
LCLo (yayınlanan en düşük)
|
33,082 ppm (kedi, 6 saat) 37,594 ppm (fare, 2 saat) | ||
| NIOSH (ABD sağlık maruziyet limitleri): | |||
PEL (İzin Verilebilir)
|
TWA 200 ppm (260 mg/m3) | ||
REL (Önerilen)
|
TWA 200 ppm (260 mg/m3) ST 250 ppm (325 mg/m3) [cilt] | ||
IDLH (Acil tehlike)
|
6000 ppm | ||
| Güvenlik bilgi formu (SDS) | [1] | ||
| İlgili bileşikler | |||
İlgili bileşikler
|
Metanethiol Silanol Etanol | ||
Aksi belirtilmedikçe, veriler standart durumdaki malzemeler için verilmiştir (25 °C [77 °F], 100 kPa'da).
Bilgi kutusu referansları
| |||
Diğer isimlerinin yanı sıra metil alkol olarak da bilinen metanol, CH3OH (bir hidroksil grubuna bağlı bir metil grubu, genellikle MeOH olarak kısaltılır) formülüne sahip organik bir kimyasal ve en basit alkoldür. Hafif, uçucu, renksiz, yanıcı bir sıvıdır ve etanole (içilebilir alkol) benzer belirgin bir alkolik kokusu vardır. Polar bir çözücü olan metanol, bir zamanlar esas olarak odunun tahrip edici damıtılmasıyla üretildiği için odun alkolü adını almıştır. Günümüzde metanol esas olarak karbon monoksitin hidrojenasyonu yoluyla endüstriyel olarak üretilmektedir. ⓘ
Metanol, polar bir hidroksil grubuna bağlı bir metil grubundan oluşur. Yılda 20 milyon tondan fazla üretilen metanol, formaldehit, asetik asit, metil tert-bütil eter, metil benzoat, anizol, peroksiasitler gibi diğer emtia kimyasallarının yanı sıra bir dizi daha özel kimyasalın öncüsü olarak kullanılır. ⓘ
| Metanol ⓘ | |
|---|---|

| |

| |

| |
IUPAC adı Methanol | |
Sistematik ad Metanol | |
Diğer adlar Metil alkol, karbinol, metil hidroksit, metilol, hidroksimetan | |
| Tanımlayıcılar | |
| Kısaltmalar | MeOH, UN 1230 |
| CAS numarası | 67-56-1 |
| UN numarası | 1230 |
| SMILES |
|
| Özellikler | |
| Kimyasal formül | CH4O |
| Molekül kütlesi | 32,04 g mol−1 |
| Görünüm | renksiz sıvı |
| Yoğunluk | 0.792 g/cm3 |
| Erime noktası |
-97.6°C |
| Kaynama noktası |
64.7°C |
| Asitlik (pKa) | 15.5 |
| Tehlikeler | |
| Ana tehlikeler | Yutulması ve solunması körlüğe sebep verebilir, ölümle sonuçlanabilir. Çok yanıcıdır. |
| NFPA 704 | |
| Benzeyen bileşikler:Şablon:Chembox templatePar/formatPreviewMessage | |
Benzeyen bileşikler
|
Etanol |
| Belirtilmiş yerler dışında verilmiş olan veriler, Standart sıcaklık ve basınçtadır. (25 °C, 100 kPa) | |
| Bilgi kutusu kaynakları | |
Metanol ya da metil alkol (CH3OH ya da kısaca MeOH), en basit yapılı alkol. Geçmişte odunun damıtılması ile elde edildiğinden odun alkolü de denir. Günümüzde metanol, karbonmonoksit ile hidrojenin yüksek basınç altında yüksek sıcaklıklara maruz bırakılması ile üretilir. Renksiz, uçucu, suda tamamen karışan bir sıvıdır. ⓘ
Oluşum
Normal, sağlıklı insan bireylerinde az miktarda metanol bulunur. Bir çalışmada deneklerin nefeslerinde ortalama 4,5 ppm bulunmuştur. İnsanlarda ortalama 0,45 g/gün endojen metanol, meyvelerde bulunan pektinden metabolize olabilir; bir kilogram elma 1,4 g metanol üretir. ⓘ
Metanol anaerobik bakteriler ve fitoplanktonlar tarafından üretilir. ⓘ
Yıldızlararası ortam
Metanol ayrıca uzayın yıldız oluşturan bölgelerinde bol miktarda bulunur ve astronomide bu tür bölgeler için bir işaretleyici olarak kullanılır. Spektral emisyon çizgileri aracılığıyla tespit edilir. ⓘ
2006 yılında Jodrell Bank Gözlemevi'ndeki MERLIN radyo teleskop dizisini kullanan gökbilimciler uzayda 463 terametre (288 milyar mil) genişliğinde büyük bir metanol bulutu keşfettiler. 2016 yılında gökbilimciler ALMA radyo teleskobunu kullanarak genç yıldız TW Hydrae'nin etrafında gezegen oluşturan bir diskte metanol tespit ettiler. ⓘ
Güvenlik
Metanol oldukça yanıcıdır. Buharları havadan biraz daha ağırdır, hareket edebilir ve tutuşabilir. Metanol yangınları kuru kimyasal, karbondioksit, su spreyi veya alkole dayanıklı köpük ile söndürülmelidir. ⓘ
Zehirlilik
Saf metanolün 10 mL (0,34 US fl oz) kadar az bir miktarının yutulması optik sinirin tahrip olmasıyla kalıcı körlüğe neden olabilir. 30 mL (1,0 US fl oz) potansiyel olarak ölümcüldür. Medyan öldürücü doz 100 mL (3,4 US fl oz), yani 1-2 mL/kg vücut ağırlığı saf metanoldür. Metanol için referans doz günde 0,5 mg/kg'dır. Toksik etkiler yutulduktan saatler sonra başlar ve antidotlar genellikle kalıcı hasarı önleyebilir. Hem görünüş hem de koku olarak etanole (içkilerdeki alkol) benzerliği nedeniyle, ikisi arasında ayrım yapmak zordur; denatüre alkol, tağşiş edilmiş likörler veya çok düşük kaliteli alkollü içeceklerde de durum böyledir. ⓘ
Metanol iki mekanizma ile toksiktir. İlk olarak, metanol merkezi sinir sistemi üzerindeki etkileri nedeniyle ölümcül olabilir, etanol zehirlenmesi ile aynı şekilde merkezi sinir sistemi depresanı olarak hareket eder. İkinci olarak, bir toksikasyon sürecinde, karaciğerdeki alkol dehidrojenaz enzimi tarafından başlatılan bir süreçte formaldehit yoluyla formik aside (format iyonu olarak bulunur) metabolize edilir. Metanol, alkol dehidrojenaz (ADH) yoluyla formaldehide dönüştürülür ve formaldehit de aldehit dehidrojenaz (ALDH) yoluyla formik aside (format) dönüştürülür. ALDH aracılığıyla formata dönüşüm tamamen gerçekleşir ve geriye tespit edilebilir formaldehit kalmaz. Format toksiktir çünkü mitokondriyal sitokrom c oksidazı inhibe ederek hücresel düzeyde hipoksiye ve diğer çeşitli metabolik bozuklukların yanı sıra metabolik asidoza neden olur. ⓘ
Metanol zehirlenmesi salgınları öncelikle içme alkolünün kontaminasyonu nedeniyle meydana gelmiştir. Bu durum gelişmekte olan ülkelerde daha yaygındır. Bununla birlikte 2013 yılında Amerika Birleşik Devletleri'nde 1700'den fazla vaka meydana gelmiştir. Etkilenenler genellikle yetişkin erkeklerdir. Erken tedavi ile sonuçlar iyi olabilir. Metanol toksisitesi 1856 gibi erken bir tarihte tanımlanmıştır. ⓘ
Toksik özellikleri nedeniyle metanol, endüstriyel kullanım için üretilen etanolde denatürant katkı maddesi olarak sıklıkla kullanılmaktadır. Bu metanol ilavesi, endüstriyel etanolü (genellikle "denatüre alkol" veya "metillenmiş ispirto" olarak bilinir) ABD'de ve diğer bazı ülkelerde içki tüketim vergisinden muaf tutmaktadır. ⓘ
COVID-19 salgını sırasında, ABD Gıda ve İlaç İdaresi, etanol içerdiği belirtilen ancak metanol kontaminasyonu açısından pozitif test edilen bir dizi el dezenfektanı ürününün satıldığını tespit etmiştir. Nispeten daha güvenli olan etanolün aksine, metanolün ciltten emildiğinde veya yutulduğunda toksik etkileri nedeniyle FDA, metanol içeren bu tür el dezenfektanı ürünlerinin toplatılmasını emretti ve bu ürünlerin ABD pazarına yasadışı yollardan girmesini engellemek için bir ithalat uyarısı yayınladı. ⓘ
Metanol zehirlenmesi, panzehiri olan etanol veya fomepizol ile tedavi edilebilir. Her iki bileşik, alkol dehidrojenazın metanol üzerine olan etkisini yarışmalı inhibisyon ile indirger. Bu şekilde, toksik metabolitlere dönüşüm yerine böbrekler ile vücuttan atılır. Akabindeki tedavi, metabolik asidoz için sodyum bikarbonatın verilmesi ve metanol ile formatın kandan uzaklaştırılması için hemodiyaliz olabilir. Folinik asit/folik asit de formatın metabolize edilmesini kuvvetlendirmek açısından uygulanmaktadır. ⓘ
Metanol zehirlenmesinin başlıca semptomları, MSS baskılanması, baş ağrısı, baş dönmesi, bulantı, koordinasyon kaybı ve sersemlik halidir. Çok yüksek dozlar bilinç kaybı ve ölümle sonuçlanabilir. Bu belirtilerin 10-30 saat sonrasında görmede bulanıklık/kayıp ve asidoz gözlenir. Bu semptomlar, formatın toksik seviyede kanda birikiminden kaynaklanır ve solunum güçlüğüne neden olarak ölüm ile sonuçlanabilir. Gıda metabolizması sonucundan üretilen ufak miktarlardaki metanol, zararsız olup hızlı ve tam bir şekilde metabolize edilir. ⓘ

Uygulamalar
Formaldehit, asetik asit, metil tert-bütileter
Metanol öncelikle başta polimerler olmak üzere birçok alanda yaygın olarak kullanılan formaldehite dönüştürülür. Dönüşüm oksidasyonu gerektirir:
Asetik asit metanolden üretilebilir. ⓘ

Metanol ve izobüten birleştirilerek metil tert-bütil eter (MTBE) elde edilir. MTBE benzinde önemli bir oktan artırıcıdır. ⓘ
Metanolden hidrokarbonlara, olefinlere, benzine
Hidrokarbonlar ve hatta aromatik sistemler üretmek için metanolün yoğunlaştırılması, gazdan sıvılara ilişkin çeşitli teknolojilerin temelini oluşturmaktadır. Bunlar arasında metanolden hidrokarbonlara (MtH), metanolden benzine (MtG), metanolden olefinlere (MtO) ve metanolden propilene (MtP) dönüşümler sayılabilir. Bu dönüşümler heterojen katalizörler olarak zeolitler tarafından katalize edilir. MtG prosesi bir zamanlar Yeni Zelanda'daki Motunui'de ticarileştirilmiştir. ⓘ
Benzin katkı maddesi
Avrupa Yakıt Kalitesi Direktifi, yakıt üreticilerinin Avrupa'da satılan benzine eşit miktarda yardımcı çözücü ile %3'e kadar metanol karıştırmasına izin vermektedir. Çin, geleneksel araçlar için düşük seviyeli karışımlarda ve metanol yakıtlar için tasarlanmış araçlarda yüksek seviyeli karışımlarda ulaşım yakıtı olarak yılda 4,5 milyar litreden fazla metanol kullanmaktadır. Ancak son yıllarda, benzin kullanan modern araçların çoğu, aracın yazılım ayarlarında basit bir değişiklik ve muhtemelen 50 sentlik bir conta veya boru parçası karşılığında benzer veya daha yüksek beygir gücü sağlayan çeşitli alkol yakıtları kullanabilmektedir. ⓘ
Diğer kimyasallar
Metanol, çoğu basit metilaminlerin, metil halojenürlerin ve metil eterlerin öncüsüdür. Metil esterler, yağların transesterifikasyonu ve transesterifikasyon yoluyla biyodizel üretimi de dahil olmak üzere metanolden üretilir. ⓘ
Niş ve potansiyel kullanım alanları
Enerji taşıyıcı
Metanol umut verici bir enerji taşıyıcısıdır çünkü bir sıvı olarak depolanması hidrojen ve doğal gazdan daha kolaydır. Bununla birlikte, enerji yoğunluğu kg başına metandan daha düşüktür. Yanma enerji yoğunluğu 15.6 MJ/L iken, etanolünki 24 ve benzininki 33 MJ/L'dir. ⓘ
Metanolün diğer avantajları biyolojik olarak parçalanmaya hazır olması ve düşük çevresel toksisitesidir. Aerobik (oksijen bulunan) ya da anaerobik (oksijen bulunmayan) ortamlarda kalıcı değildir. Metanolün yeraltı sularındaki yarılanma ömrü sadece bir ila yedi gün arasındayken, birçok yaygın benzin bileşeninin yarılanma ömrü yüzlerce gündür (örneğin benzen 10-730 gün). Metanol suyla karışabilir ve biyolojik olarak parçalanabilir olduğundan, yeraltı sularında, yüzey sularında, havada veya toprakta birikmesi olası değildir. ⓘ
Yakıt
Metanol zaman zaman içten yanmalı motorlara yakıt sağlamak için kullanılır. Yanarak karbondioksit ve su oluşturur:
Metanol yakıtı kara taşımacılığı için önerilmiştir. Metanol ekonomisinin başlıca avantajı, motorlarda ve sıvı yakıt sağlayan ve depolayan altyapıda minimum değişiklikle benzinli içten yanmalı motorlara adapte edilebilmesidir. Bununla birlikte, enerji yoğunluğu benzinden daha azdır, bu da daha sık doldurma gerekeceği anlamına gelir. Bununla birlikte, beygir gücü açısından süper yüksek oktanlı benzine eşdeğerdir ve çoğu modern bilgisayar kontrollü yakıt enjeksiyon sistemi zaten bunu kullanabilir. ⓘ
Metanol, gemiler için alternatif bir yakıttır ve denizcilik endüstrisinin giderek daha katı hale gelen emisyon düzenlemelerini karşılamasına yardımcı olur. Sülfür oksit (SOx), nitrojen oksit (NOx) ve partikül madde emisyonlarını önemli ölçüde azaltır. Metanol, az miktarda pilot yakıt (Çift yakıt) kullanılarak yapılan küçük değişikliklerden sonra deniz dizel motorlarında yüksek verimlilikle kullanılabilir. ⓘ
Çin'de metanol, çeşitli endüstriyel uygulamalar ve konut ısıtması için ısı ve buhar üretmek amacıyla yaygın olarak kullanılan endüstriyel kazanlara yakıt sağlamaktadır. Kullanımı, giderek daha sıkı hale gelen çevre düzenlemelerinin baskısı altında olan kömürün yerini almaktadır. ⓘ
Doğrudan metanol yakıt hücreleri, büyük ölçüde minyatürleştirilmelerini sağlayan düşük sıcaklıkta, atmosferik basınçta çalışmaları bakımından benzersizdir. Bu durum, metanolün nispeten kolay ve güvenli bir şekilde depolanması ve işlenmesiyle birleştiğinde, dizüstü bilgisayarlar ve cep telefonları gibi yakıt hücresiyle çalışan tüketici elektroniğinin önünü açabilir. ⓘ
Metanol aynı zamanda kamp ve tekne sobalarında da yaygın olarak kullanılan bir yakıttır. Metanol basınçsız bir brülörde iyi yanar, bu nedenle alkol sobaları genellikle çok basittir, bazen yakıt tutmak için bir kaptan biraz daha fazlasıdır. Bu karmaşıklık eksikliği, onları vahşi doğada uzun zaman geçiren yürüyüşçülerin gözdesi yapar. Benzer şekilde, "Sterno" markasında olduğu gibi sızıntı veya dökülme riskini azaltmak için alkol jelleştirilebilir. ⓘ
Metanol su ile karıştırılarak yüksek performanslı dizel ve benzinli motorlara enjekte edilmekte ve su metanol enjeksiyonu olarak bilinen bir işlemle güç artışı ve emme havası sıcaklığında düşüş sağlanmaktadır. ⓘ
Diğer uygulamalar
Metanol, etanol için bir denatürant olarak kullanılır, ürün "denatüre alkol" veya "metillenmiş ispirto" olarak bilinir. Bu, İçki Yasağı sırasında kaçak içki tüketimini caydırmak için yaygın olarak kullanılmış ve çok sayıda ölüme neden olmuştur. Bu tür uygulamalar artık Amerika Birleşik Devletleri'nde yasadışıdır ve cinayet olarak kabul edilmektedir. ⓘ
Metanol, boru hatlarında ve cam yıkama sıvısında çözücü ve antifriz olarak kullanılır. Metanol 1900'lerin başında otomobil soğutucu antifrizi olarak kullanılmıştır. Mayıs 2018 itibariyle metanol, 2012 Çek Cumhuriyeti metanol zehirlenmelerinin bir sonucu olarak insan tüketimi riski nedeniyle AB'de ön cam yıkama veya buz çözme işlemlerinde kullanılması yasaklanmıştır. ⓘ
Bazı atık su arıtma tesislerinde, nitratları nitrojen gazına dönüştüren ve hassas akiferlerin nitrifikasyonunu azaltan denitrifikasyon bakterileri için bir karbon besin kaynağı sağlamak amacıyla atık suya az miktarda metanol eklenir. ⓘ
Metanol, poliakrilamid jel elektroforezinde bir destaining ajanı olarak kullanılır. ⓘ
Üretim
Sentez gazından
Karbon monoksit ve hidrojen, metanol üretmek için bir katalizör üzerinde reaksiyona girer. Günümüzde en yaygın kullanılan katalizör, ilk olarak 1966 yılında ICI tarafından kullanılan, alümina üzerinde desteklenen bakır ve çinko oksit karışımıdır. 5-10 MPa (50-100 atm) ve 250 °C'de (482 °F), reaksiyon
- Ayrıştırılamadı (sözdizim hatası): {\displaystyle \ce{CO + 2 H2 -> CH3OH <span title="Kaynak: İngilizce Vikipedi, Bölüm "From synthesis gas"" class="plainlinks">[https://en.wikipedia.org/wiki/Methanol#From_synthesis_gas <span style="color:#dddddd">ⓘ</span>]</span>}}
yüksek seçicilik (>%99,8) ile karakterize edilir. Metandan sentez gazı üretimi her bir mol karbon monoksit için üç mol hidrojen üretirken, sentez her bir mol karbon monoksit için sadece iki mol hidrojen gazı tüketir. Fazla hidrojenle başa çıkmanın bir yolu, metanol sentez reaktörüne karbondioksit enjekte etmektir, burada da denkleme göre metanol oluşturmak için reaksiyona girer
- . ⓘ
Mekanizma açısından, süreç CO'nun CO2'ye ilk dönüşümü yoluyla gerçekleşir ve daha sonra hidrojenlenir:
H2O yan ürününün su-gaz kayması reaksiyonu yoluyla geri dönüştürüldüğü yer
- .
Bu da genel bir reaksiyon verir
- ,
Bu da yukarıda listelenenlerle aynıdır. Sentez gazından metanol üretimi ile yakından ilgili bir süreçte, hidrojen ve CO2 beslemesi doğrudan kullanılabilir. Bu sürecin ana avantajı, elektrolizden elde edilen CO2 ve hidrojenin kullanılabilmesi ve fosil yakıtlara olan bağımlılığın ortadan kaldırılmasıdır. ⓘ
Biyosentez
Metanın metanole katalitik dönüşümü, metan monooksijenazları içeren enzimler tarafından gerçekleştirilir. Bu enzimler karışık fonksiyonlu oksijenazlardır, yani oksijenasyon su ve NAD+ üretimi ile birleşir:
- . ⓘ
Hem Fe- hem de Cu-bağımlı enzimler karakterize edilmiştir. Bu reaktiviteyi taklit etmek için yoğun ancak büyük ölçüde sonuçsuz çabalar sarf edilmiştir. Metanol, hammadde metana göre daha kolay oksitlenir, bu nedenle reaksiyonlar seçici olmama eğilimindedir. Bu sorunu aşmak için bazı stratejiler mevcuttur. Örnekler arasında Shilov sistemleri ve Fe- ve Cu içeren zeolitler bulunmaktadır. Bu sistemler metaloenzimler tarafından kullanılan mekanizmaları taklit etmek zorunda değildir, ancak onlardan biraz ilham alırlar. Aktif bölgeler, enzimlerde bilinenlerden önemli ölçüde farklılık gösterebilir. Örneğin, sMMO enziminde bir dinükleer aktif bölge önerilirken, Fe-zeolitte bir mononükleer demir (alfa-oksijen) önerilmektedir. ⓘ
Kalite özellikleri ve analiz
Metanol ticari olarak çeşitli saflık derecelerinde mevcuttur. Ticari metanol genellikle ASTM saflık dereceleri A ve AA'ya göre sınıflandırılır. Hem A hem de AA saflık derecesi ağırlıkça %99,85 metanoldür. "AA" sınıfı metanol eser miktarda etanol de içerir. ⓘ
Kimyasal kullanım için metanol normalde AA derecesine karşılık gelir. Suya ek olarak, tipik safsızlıklar arasında aseton ve etanol (damıtma yoluyla ayrılması çok zordur) bulunur. UV-vis spektroskopisi aromatik safsızlıkları tespit etmek için uygun bir yöntemdir. Su içeriği Karl-Fischer titrasyonu ile belirlenebilir. ⓘ
Tarihçe
Eski Mısırlılar mumyalama işleminde, aralarında odunun pirolizinden elde ettikleri metanolün de bulunduğu bir madde karışımı kullanmışlardır. Ancak saf metanol ilk kez 1661 yılında Robert Boyle tarafından buxus (şimşir) ağacının damıtılması yoluyla izole edilmiştir. Daha sonra "piroksil ruhu" olarak tanınmıştır. 1834 yılında Fransız kimyagerler Jean-Baptiste Dumas ve Eugene Peligot elementel bileşimini belirlediler. ⓘ
Ayrıca, Yunanca methy = "alkollü sıvı" + hȳlē = "orman, odun, kereste, malzeme" kelimelerinden oluşturdukları "methylène" kelimesini organik kimyaya kazandırdılar. "Methylène", ağırlıkça yaklaşık %14 hidrojen ve bir karbon atomu içeren bir "radikal "i tanımlıyordu. Bu CH2 olacaktı, ancak o zamanlar karbonun atom ağırlığının hidrojenin sadece altı katı olduğu düşünülüyordu, bu yüzden formülü CH olarak verdiler. Daha sonra odun alkolüne (l'esprit de bois) "bihydrate de méthylène" (bihydrate çünkü formülün C4H8O4 = (CH)4(H2O)2 olduğunu düşünüyorlardı) adını verdiler. "Metil" terimi yaklaşık 1840 yılında "metilen "den geri dönüşüm yoluyla türetilmiş ve daha sonra "metil alkol "ü tanımlamak için kullanılmıştır. Bu terim 1892 yılında Uluslararası Kimyasal Adlandırma Konferansı tarafından "metanol" olarak kısaltılmıştır. Organik kimyada karbon gruplarının isimlerini oluşturan -yl son eki metil kelimesinden gelmektedir. ⓘ
Fransız kimyager Paul Sabatier, 1905 yılında sentetik olarak metanol üretmek için kullanılabilecek ilk süreci sundu. Bu süreç, karbondioksit ve hidrojenin metanol üretmek için reaksiyona sokulabileceğini öne sürdü. Badische-Anilin & Soda-Fabrik (BASF) için çalışan Alman kimyagerler Alwin Mittasch ve Mathias Pier, sentez gazını (karbon monoksit, karbon dioksit ve hidrojen karışımı) metanole dönüştürmek için bir araç geliştirdi ve patent aldı. Bozzano ve Manenti'ye göre BASF'nin süreci ilk olarak 1923 yılında Almanya'nın Leuna kentinde kullanıldı. Çalışma koşulları, çinko/krom oksit katalizörlü "yüksek" sıcaklıklar (300 ila 400 °C arasında) ve basınçlardan (250 ila 350 atm arasında) oluşuyordu. ⓘ
ABD patenti 1,569,775 (US 1569775) için 4 Eylül 1924'te başvurulmuş ve 12 Ocak 1926'da BASF'ye verilmiştir; süreçte son derece güçlü koşullara sahip bir krom ve manganez oksit katalizörü kullanılmıştır: 50 ila 220 atm arasında değişen basınçlar ve 450 °C'ye kadar sıcaklıklar. Modern metanol üretimi, daha düşük basınçlarda çalışabilen katalizörlerin (genellikle bakır) kullanılmasıyla daha verimli hale getirilmiştir. Modern düşük basınçlı metanol (LPM) prosesi ICI tarafından 1960'ların sonunda US 3326956 ile geliştirilmiştir ve teknoloji patentinin süresi çoktan dolmuştur. ⓘ
İkinci Dünya Savaşı sırasında metanol, M-Stoff adı altında çeşitli Alman askeri roket tasarımlarında yakıt olarak ve C-Stoff olarak bilinen hidrazin ile kabaca 50/50 karışım halinde kullanılmıştır. ⓘ
Metanolün motor yakıtı olarak kullanımı 1970'lerdeki petrol krizleri sırasında dikkat çekmiştir. ABD'de 1990'ların ortalarında metanol veya benzinle çalışabilen 20.000'den fazla metanollü "esnek yakıtlı araç" (FFV) piyasaya sürülmüştür. Ayrıca 1980'lerin büyük bir kısmında ve 1990'ların başında Avrupa'da satılan benzinli yakıtlara düşük seviyelerde metanol karıştırılmıştır. Otomobil üreticileri 1990'ların sonunda metanol FFV'lerin üretimini durdurarak dikkatlerini etanol yakıtlı araçlara çevirdi. Metanol FFV programı teknik açıdan başarılı olsa da, benzin pompa fiyatlarının düştüğü bir dönemde 1990'ların ortasından sonuna kadar yükselen metanol fiyatları metanol yakıtlara olan ilgiyi azalttı. ⓘ
1970'lerin başında Mobil tarafından metanolden benzin yakıtı üretmek için bir süreç geliştirildi. ⓘ
1960'lar ve 1980'ler arasında metanol, hammadde kimyasalları asetik asit ve asetik anhidrit için bir öncül olarak ortaya çıkmıştır. Bu prosesler arasında Monsanto asetik asit sentezi, Cativa prosesi ve Tennessee Eastman asetik anhidrit prosesi bulunmaktadır. ⓘ
Özellikleri
Saf metanol 1 atm'de 64,6 derecede kaynayan akışkan bir sıvı olup, parlak olmayan mavimsi bir alevle yanar. Bütün organik çözücülerde her oranda çözünür. Çok az miktardaki metanol dahi canlı organizma için zehirdir. Kalıcı yaralar, bozukluklar meydana getirir. 25 gram metanol içilirse insanlarda körlüğe neden olur. ⓘ

Elde edilişi
Metanol ilk defa 1661'de odunun kuru damıtılması (havasız ortamda yüksek ısı verilmesi) ile elde edildi. Damıtma ürününde % 1,5-3 metanol, % 10 asetik asit, % 0,5 aseton ve başkaları bulunmaktadır. ⓘ
Endüstride, karbonmonoksit ile hidrojenin reaksiyonundan elde edilir. Bu metotla saf metanol elde edilirse de sıcaklığın 30-40 derece yükselmesi halinde n-propanol ve izobütanol teşekkül edebilir. ⓘ
Fraksiyonlu destilasyonla sulu çözeltisinden % 99’luk bir saflıkta elde edilir. Susuz (mutlak) metanol elde etmek için Mg kullanılır:
- 2 CH3OH + Mg → (CH3O)2Mg + H2 ⓘ
- (CH3O)2Mg + H2O → 2 CH3OH + MgO ⓘ
Daha fazla okuma
- Biochem. Pharmacol. 28 (5): 645–9. doi:10.1016/0006-2952(79)90149-7. PMID 109089.
- Casavant MJ (Jan 2001). "Fomepizole in the treatment of poisoning". Pediatrics 107 (1): 170. doi:10.1542/peds.107.1.170. PMID 11134450.
- Brent J (May 2009). "Fomepizole for ethylene glycol and methanol poisoning". N Engl J Med 360 (21): 2216–23. doi:10.1056/NEJMct0806112. PMID 19458366.
- Schep LJ, Slaughter RJ, Vale JA, Beasley DM (Sep 30 2009). "A seaman with blindness and confusion". BMJ 339: b3929. doi:10.1136/bmj.b3929. PMID 19793790. ⓘ