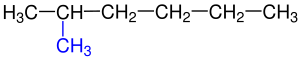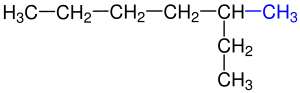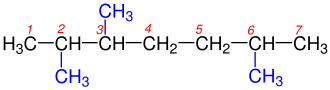Alkan
Organik kimyada, bir alkan veya parafin (başka anlamları da olan tarihsel önemsiz bir isim), asiklik doymuş bir hidrokarbondur. Başka bir deyişle, bir alkan, tüm karbon-karbon bağlarının tek olduğu bir ağaç yapısında düzenlenmiş hidrojen ve karbon atomlarından oluşur. Alkanlar genel kimyasal formül CnH2n+2'ye sahiptir. Alkanlar, n = 1 (bazen ana molekül olarak adlandırılır) olan en basit metan (CH4) durumundan, pentakontan (C50H102) veya tetradekanın (C14H30) bir izomeri olan 6-etil-2-metil-5-(1-metiletil) oktan gibi keyfi olarak büyük ve karmaşık moleküllere kadar karmaşıklık gösterir. ⓘ
Uluslararası Saf ve Uygulamalı Kimya Birliği (IUPAC) alkanları "genel formülü CnH2n+2 olan ve dolayısıyla tamamen hidrojen atomları ve doymuş karbon atomlarından oluşan asiklik dallanmış veya dallanmamış hidrokarbonlar" olarak tanımlamaktadır. Bununla birlikte, bazı kaynaklar bu terimi, farklı bir genel formüle sahip olmalarına rağmen (yani sikloalkanlar CnH2n'dir) monosiklik (yani sikloalkanlar) veya polisiklik olanlar da dahil olmak üzere herhangi bir doymuş hidrokarbonu ifade etmek için kullanmaktadır. ⓘ
Bir alkan içinde her bir karbon atomu 4 sigma bağı (C-C veya C-H) ile sp3-hibritleşmiştir ve her bir hidrojen atomu karbon atomlarından birine (bir C-H bağı ile) bağlanmıştır. Bir moleküldeki en uzun bağlı karbon atomları serisi, karbon iskeleti veya karbon omurgası olarak bilinir. Karbon atomlarının sayısı alkanın büyüklüğü olarak düşünülebilir. ⓘ
Yüksek alkanların bir grubu, karbon omurgasındaki karbon atomu sayısının yaklaşık 17'den fazla olduğu, standart ortam sıcaklığı ve basıncında (SATP) katı olan mumlardır. Tekrarlanan -CH2 birimleri ile alkanlar, üyelerinin moleküler kütlede 14.03 u'nun katları kadar farklılık gösterdiği homolog bir organik bileşikler serisi oluşturur (12.01 u kütleli tek bir karbon atomu ve her biri ~1.01 u kütleli iki hidrojen atomu içeren bu tür metilen köprüsü birimlerinin her birinin toplam kütlesi). ⓘ
Metan, metanojenik bakteriler tarafından üretilir ve bazı uzun zincirli alkanlar belirli hayvan türlerinde feromon olarak veya bitki ve mantarlarda koruyucu mum olarak işlev görür. Bununla birlikte, çoğu alkanın fazla biyolojik aktivitesi yoktur. Biyolojik moleküllerin daha aktif/reaktif fonksiyonel gruplarının üzerine asılabileceği moleküler ağaçlar olarak görülebilirler. ⓘ
Alkanların iki ana ticari kaynağı vardır: petrol (ham petrol) ve doğal gaz. ⓘ
Bir alkil grubu, bağlanma için bir açık değerlik taşıyan alkan bazlı bir moleküler parçadır. Genellikle herhangi bir organil grubunun sembolü olan R ile kısaltılırlar, ancak Alk bazen bir alkil grubunu (bir alkenil grubu veya aril grubunun aksine) özellikle sembolize etmek için kullanılır. ⓘ
Yapı ve sınıflandırma
Normalde C-C tek bağ mesafesi 1,53 ångström'dür (1,53×10-10 m). Doymuş hidrokarbonlar doğrusal, dallanmış veya halkalı olabilir. Üçüncü grup bazen sikloalkanlar olarak adlandırılır. Doğrusal, dallı, halkalı alkanların birleştirilmesiyle çok karmaşık yapılar mümkündür. ⓘ
İzomerizm
Bisiklo[1.1.0]bütan tek C4H6 alkandır ve alkan izomeri yoktur; tetrahedran (aşağıda) tek C4H4 alkandır ve bu nedenle alkan izomeri yoktur. ⓘ
Üçten fazla karbon atomuna sahip alkanlar çeşitli şekillerde düzenlenerek yapısal izomerler oluşturabilir. Bir alkanın en basit izomeri, karbon atomlarının dallanmadan tek bir zincir halinde düzenlendiği izomerdir. Bu izomer bazen n-izomer olarak adlandırılır ("normal" için n, her ne kadar en yaygın olanı olmasa da). Bununla birlikte, karbon atomları zinciri bir veya daha fazla noktada dallanmış da olabilir. Olası izomerlerin sayısı karbon atomu sayısı ile hızla artar. Örneğin, asiklik alkanlar için:
- C1: sadece metan
- C2: sadece etan
- C3: sadece propan
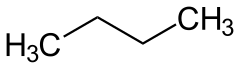
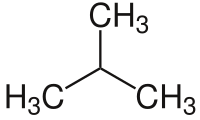
- C4: 2 izomer: bütan ve izobütan
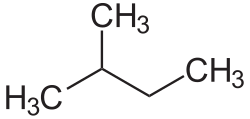
- C5: 3 izomer: pentan, izopentan ve neopentan
- C6: 5 izomer: hekzan, 2-metilpentan, 3-metilpentan, 2,2-dimetilbütan ve 2,3-dimetilbütan
- C7: 9 izomer: heptan, metilhekzan (2 izomer), dimetilpentan (4 izomer), 3-etilpentan, 2,2,3-trimetilbütan
- C8: 18 izomer: 4-dimetilhekzan, 2,2,4-trimetilpentan, 2,3,3-Trimetilpentan, 3,3,4-trimetil-pentan, 3,4,4-trimetilpentan, 2,4,4-trimetilpentan, (5 izomer)
- C9: 35 izomer
- C10: 75 izomer
- C12: 355 izomerleri
- C32: 27.711.253.769 izomer
- C60: 22,158,734,535,770,411,074,184 izomeri vardır ve bunların çoğu kararlı değildir. ⓘ
Dallanmış alkanlar kiral olabilir. Örneğin, 3-metilheksan ve daha yüksek homologları, 3 numaralı karbon atomundaki stereojenik merkezleri nedeniyle kiraldir. Yukarıdaki liste sadece bağlantı farklılıklarını içerir, stereokimyayı içermez. Alkan izomerlerine ek olarak, karbon atomları zinciri bir veya daha fazla halka oluşturabilir. Bu tür bileşiklere sikloalkan adı verilir ve halka sayısının değiştirilmesi moleküler formülü değiştirdiğinden yukarıdaki listenin dışında tutulur. Örneğin, siklobütan ve metilsiklopropan birbirlerinin izomerleridir (C4H8), ancak bütanın (C4H10) izomerleri değildir. ⓘ
İsimlendirme
Alkanlar için IUPAC isimlendirmesi (bileşikleri adlandırmanın sistematik yolu) hidrokarbon zincirlerini tanımlamaya dayanır. Dallanmamış, doymuş hidrokarbon zincirleri, karbon sayısını belirten Yunanca bir sayısal ön ek ve "-ane" son eki ile sistematik olarak adlandırılır. ⓘ
1866 yılında August Wilhelm von Hofmann, CnH2n+2, CnH2n, CnH2n-2, CnH2n-4, CnH2n-6 hidrokarbonları için -ane, -ene, -ine (veya -yne), -one, -une eklerini oluşturmak üzere a, e, i, o ve u sesli harflerinin tüm dizisini kullanarak isimlendirmeyi sistematik hale getirmeyi önerdi. Modern isimlendirmede, ilk üçü özellikle tek, çift ve üçlü bağlara sahip hidrokarbonları adlandırırken; "-one" artık bir ketonu temsil etmektedir. ⓘ
Doğrusal alkanlar
Düz zincirli alkanlar bazen doğrusal olmayan bir izomerin mevcut olduğu durumlarda "n-" veya "n-" ("normal" için) önekiyle belirtilir. Bu kesinlikle gerekli olmamasına ve IUPAC adlandırma sisteminin bir parçası olmamasına rağmen, düz zincirli ve dallı zincirli izomerleri vurgulamak veya birbirinden ayırmak istendiği durumlarda bu kullanım hala yaygındır, örneğin izobütandan ayırmak için basitçe "bütan" yerine "n-bütan". Petrol endüstrisinde bu grup için kullanılan alternatif isimler lineer parafinler veya n-parafinlerdir. ⓘ
Serinin ilk altı üyesi (karbon atomu sayısı bakımından) aşağıdaki gibi adlandırılır:
- metan
- CH4 - bir karbon ve 4 hidrojen
- etan
- C2H6 - iki karbon ve 6 hidrojen
- propan
- C3H8 - üç karbon ve 8 hidrojen
- Bütan
- C4H10 - dört karbon ve 10 hidrojen
- pentan
- C5H12 - beş karbon ve 12 hidrojen
- hekzan
- C6H14 - altı karbon ve 14 hidrojen ⓘ
İlk dört isim metanol, eter, propiyonik asit ve bütirik asitten türetilmiştir. Beş veya daha fazla karbon atomuna sahip alkanlar, temel sayısal terimden herhangi bir terminal sesli harfin (-a veya -o) çıkarılmasıyla uygun sayısal çarpan ön ekine -ane son ekinin eklenmesiyle adlandırılır. Dolayısıyla, pentan, C5H12; hekzan, C6H14; heptan, C7H16; oktan, C8H18; vb. Rakam öneki genellikle Yunancadır, ancak karbon atomu sayısı dokuzla biten alkanlar, örneğin nonan, Latince non- önekini kullanır. Daha eksiksiz bir liste için düz zincirli alkanların listesine bakınız. ⓘ
Dallanmış alkanlar

Basit dallanmış alkanlar genellikle doğrusal alkanlardan ayırt etmek için bir ön ek kullanarak ortak bir ada sahiptir, örneğin n-pentan, izopentan ve neopentan. ⓘ
IUPAC adlandırma kuralları sistematik bir ad üretmek için kullanılabilir. ⓘ
Daha karmaşık dallanmış alkanların isimlendirilmesindeki temel adımlar aşağıdaki gibidir:
- En uzun sürekli karbon atomu zincirini tanımlayın
- Standart adlandırma kurallarını kullanarak bu en uzun kök zincirini adlandırın
- Her bir yan zinciri, alkan adının son ekini "-an" yerine "-il" olarak değiştirerek adlandırın.
- Yan zincirler için mümkün olan en düşük sayıları vermek üzere en uzun sürekli zinciri numaralandırın
- Kök zincirin adından önce yan zincirleri numaralandırın ve adlandırın
- Aynı türde birden fazla yan zincir varsa, bunu belirtmek için "di-" ve "tri-" gibi ön ekler kullanın ve her birini numaralandırın.
- Yan zincir adlarını alfabetik sırayla ("di-" vb. ön ekleri göz ardı ederek) kök zincirin adının önüne ekleyin ⓘ
| Ortak ad | n-pentan | izopentan | neopentane |
|---|---|---|---|
| IUPAC adı | pentan | 2-metilbütan | 2,2-dimetilpropan |
| Yapı |  |

|
Doymuş siklik hidrokarbonlar
Teknik olarak alkanlardan farklı olsa da, bu hidrokarbon sınıfı bazıları tarafından "siklik alkanlar" olarak adlandırılır. Tanımlarından da anlaşılacağı üzere, bir veya daha fazla halka içerirler. ⓘ
Basit sikloalkanlar, onları alkanlardan ayırmak için "siklo-" ön ekine sahiptir. Sikloalkanlar, omurgalarındaki karbon atomu sayısına göre asiklik muadillerine göre adlandırılır, örneğin siklopentan (C5H10) tıpkı pentan (C5H12) gibi 5 karbon atomuna sahip bir sikloalkandır, ancak beş üyeli bir halkada birleşmişlerdir. Benzer bir şekilde, propan ve siklopropan, bütan ve siklobütan vb. ⓘ
Sübstitüe sikloalkanlar, sübstitüe alkanlara benzer şekilde adlandırılır - sikloalkan halkası belirtilir ve sübstitüentler, Cahn-Ingold-Prelog öncelik kuralları tarafından karar verilen numaralandırma ile halka üzerindeki konumlarına göre adlandırılır. ⓘ
Önemsiz/yaygın isimler
Alkanlar için önemsiz (sistematik olmayan) isim 'parafinler'dir. Alkanlar birlikte 'parafin serisi' olarak bilinir. Bileşikler için önemsiz isimler genellikle tarihi eserlerdir. Sistematik isimlerin geliştirilmesinden önce icat edilmişlerdir ve endüstrideki tanıdık kullanım nedeniyle korunmuşlardır. Sikloalkanlara naftenler de denir. ⓘ
Dallı zincirli alkanlara izoparafinler denir. "Parafin" genel bir terimdir ve genellikle saf bileşikler ile izomer karışımları, yani pentan ve izopentan gibi aynı kimyasal formüle sahip bileşikler arasında ayrım yapmaz. ⓘ
- IUPAC'ta
Aşağıdaki önemsiz isimler IUPAC sisteminde korunmuştur:
- 2-metilpropan için izobütan
- 2-metilbütan için izopentan
- 2,2-dimetilpropan için neopentan. ⓘ
- IUPAC Dışı
IUPAC dışı bazı önemsiz isimler de zaman zaman kullanılmaktadır:
- setan, hekzadekan için
- cerane, hexacosane için ⓘ
Fiziksel özellikler
Tüm alkanlar renksizdir. En düşük molekül ağırlığına sahip alkanlar gazdır, orta molekül ağırlığına sahip olanlar sıvıdır ve en ağırları mumsu katılardır. ⓘ
Alkanlar tablosu
| Alkane | Formül | Kaynama noktası [°C] | Erime noktası [°C] | Yoğunluk [kg/m3] (20 °C'de) | İzomerler ⓘ |
| Metan | CH4 | −162 | −182 | 0,656 (gaz) | 1 |
| Etan | C2H6 | −89 | −183 | 1,26 (gaz) | 1 |
| Propan | C3H8 | −42 | −188 | 2.01 (gaz) | 1 |
| Bütan | C4H10 | 0 | −138 | 2,48 (gaz) | 2 |
| Pentan | C5H12 | 36 | −130 | 626 (sıvı) | 3 |
| Hekzan | C6H14 | 69 | −95 | 659 (sıvı) | 5 |
| Heptan | C7H16 | 98 | −91 | 684 (sıvı) | 9 |
| Oktan | C8H18 | 126 | −57 | 703 (sıvı) | 18 |
| Nonane | C9H20 | 151 | −54 | 718 (sıvı) | 35 |
| Decane | C10H22 | 174 | −30 | 730 (sıvı) | 75 |
| Undecane | C11H24 | 196 | −26 | 740 (sıvı) | 159 |
| Dodecane | C12H26 | 216 | −10 | 749 (sıvı) | 355 |
| Tridecane | C13H28 | 235 | −5.4 | 756 (sıvı) | 802 |
| Tetradekan | C14H30 | 253 | 5.9 | 763 (sıvı) | 1858 |
| Pentadekan | C15H32 | 270 | 10 | 769 (sıvı) | 4347 |
| Hekzadekan | C16H34 | 287 | 18 | 773 (sıvı) | 10,359 |
| Heptadekan | C17H36 | 303 | 22 | 777 (katı) | 24,894 |
| Oktadekan | C18H38 | 317 | 28 | 781 (katı) | 60,523 |
| Nonadecane | C19H40 | 330 | 32 | 785 (katı) | 148,284 |
| Icosane | C20H42 | 343 | 37 | 789 (katı) | 366,319 |
| Triacontane | C30H62 | 450 | 66 | 810 (katı) | 4,111,846,763 |
| Tetrakontan | C40H82 | 525 | 82 | 817 (katı) | |
| Pentakontan | C50H102 | 575 | 91 | 824 (katı) | |
| Hexacontane | C60H122 | 625 | 100 | 829 (katı) | |
| Heptacontane | C70H142 | 653 | 109 | 869 (katı) |
Kaynama noktası

Alkanlar moleküller arası van der Waals kuvvetlerine maruz kalırlar. Daha güçlü moleküller arası van der Waals kuvvetleri alkanların daha yüksek kaynama noktalarına yol açar. ⓘ
Van der Waals kuvvetlerinin gücü için iki belirleyici vardır:
- alkanın moleküler ağırlığı ile artan, molekülü çevreleyen elektron sayısı
- molekülün yüzey alanı ⓘ
Standart koşullar altında CH4'ten C4H10'a kadar alkanlar gaz halindedir; C5H12'den C17H36'ya kadar sıvıdırlar; ve C18H38'den sonra katıdırlar. Alkanların kaynama noktası öncelikle ağırlığa göre belirlendiğinden, kaynama noktasının molekülün büyüklüğü (molekül ağırlığı) ile neredeyse doğrusal bir ilişkiye sahip olması sürpriz olmamalıdır. Genel bir kural olarak, zincire eklenen her karbon için kaynama noktası 20-30 °C artar; bu kural diğer homolog seriler için de geçerlidir. ⓘ
Düz zincirli bir alkan, bitişik moleküller arasında temas halindeki daha büyük yüzey alanı ve dolayısıyla daha büyük van der Waals kuvvetleri nedeniyle dallı zincirli bir alkandan daha yüksek bir kaynama noktasına sahip olacaktır. Örneğin, -12 ve 0 °C'de kaynayan izobütan (2-metilpropan) ve n-bütan (bütan) ile sırasıyla 50 ve 58 °C'de kaynayan 2,2-dimetilbütan ve 2,3-dimetilbütanı karşılaştırın. ⓘ
Öte yandan, sikloalkanlar, moleküller arası temas düzlemi sağlayan moleküllerin kilitli konformasyonları nedeniyle doğrusal muadillerinden daha yüksek kaynama noktalarına sahip olma eğilimindedir. ⓘ
Erime noktaları
Alkanların erime noktaları, yukarıda özetlenen aynı nedenden dolayı kaynama noktalarına benzer bir eğilim izler. Yani, (diğer her şey eşit olduğunda) molekül ne kadar büyükse erime noktası da o kadar yüksek olur. Kaynama noktaları ile erime noktaları arasında önemli bir fark vardır. Katılar sıvılara göre daha katı ve sabit bir yapıya sahiptir. Bu katı yapının parçalanması için enerji gerekir. Bu nedenle, daha iyi bir araya getirilmiş katı yapıların parçalanması için daha fazla enerji gerekecektir. Alkanlar için bu durum yukarıdaki grafikten (yani mavi çizgiden) görülebilir. Tek sayılı alkanlar, çift sayılı alkanlara göre erime noktalarında daha düşük bir eğilime sahiptir. Bunun nedeni, çift sayılı alkanların katı fazda iyi bir şekilde paketlenerek, parçalanması için daha fazla enerji gerektiren iyi organize olmuş bir yapı oluşturmasıdır. Tek sayılı alkanlar daha az iyi paketlenir ve böylece "daha gevşek" organize katı paketleme yapısının parçalanması için daha az enerji gerekir. Kristal yapıların görselleştirilmesi için bkz. ⓘ
Dallı zincirli alkanların erime noktaları, yine söz konusu alkanın katı fazda iyi paketlenme kabiliyetine bağlı olarak, karşılık gelen düz zincirli alkanlarınkinden daha yüksek veya daha düşük olabilir. ⓘ
İletkenlik ve çözünürlük
Alkanlar hiçbir şekilde elektrik iletmezler ve bir elektrik alanı tarafından büyük ölçüde polarize edilmezler. Bu nedenle hidrojen bağları oluşturmazlar ve su gibi polar çözücülerde çözünmezler. Bireysel su molekülleri arasındaki hidrojen bağları bir alkan molekülünden uzağa hizalandığından, bir alkan ve suyun bir arada bulunması moleküler düzende bir artışa (entropide bir azalmaya) yol açar. Su molekülleri ve alkan molekülleri arasında önemli bir bağ olmadığından, termodinamiğin ikinci yasası, entropideki bu azalmanın alkan ve su arasındaki teması en aza indirerek en aza indirilmesi gerektiğini öne sürer: Alkanların suda çözünmedikleri için hidrofobik oldukları söylenir. ⓘ
Polar olmayan çözücülerdeki çözünürlükleri nispeten yüksektir ve bu özellik lipofiliklik olarak adlandırılır. Örneğin alkanlar kendi aralarında tüm oranlarda karışabilir. ⓘ
Alkanların yoğunluğu genellikle karbon atomu sayısı ile artar ancak suyunkinden daha az kalır. Bu nedenle, alkanlar bir alkan-su karışımında üst tabakayı oluşturur. ⓘ
Moleküler geometri
Alkanların moleküler yapısı, fiziksel ve kimyasal özelliklerini doğrudan etkiler. Bu yapı, dört değerlik elektronu olan karbonun elektron konfigürasyonundan türetilmiştir. Alkanlardaki karbon atomları sp3 melezleri olarak tanımlanır, yani iyi bir yaklaşımla, değerlik elektronları 2s orbitali ve üç 2p orbitalinin birleşiminden türetilen bir tetrahedronun köşelerine doğru yönlendirilmiş orbitallerde bulunur. Geometrik olarak, bağlar arasındaki açı cos-1(-1/3) ≈ 109.47°'dir. Bu değer metan için tamdır, C-H ve C-C bağlarının bir kombinasyonunu içeren daha büyük alkanlar ise genellikle bu idealleştirilmiş değerin birkaç derece içinde olan bağlara sahiptir. ⓘ
Bağ uzunlukları ve bağ açıları
Bir alkan sadece C-H ve C-C tek bağlarına sahiptir. İlki, bir karbonun sp3 orbitalinin bir hidrojenin 1s orbitali ile örtüşmesinden kaynaklanır; ikincisi, bitişik karbon atomları üzerindeki iki sp3 orbitalinin örtüşmesinden kaynaklanır. Bağ uzunlukları bir C-H bağı için 1.09 × 10-10 m ve bir C-C bağı için 1.54 × 10-10 m'dir. ⓘ

Bağların uzamsal düzeni dört sp3 orbitalininkine benzer - aralarında 109,47°'lik bir açı ile dört yüzlü olarak düzenlenmişlerdir. Bağları birbirlerine dik açılı olarak temsil eden yapısal formüller, hem yaygın hem de kullanışlı olmakla birlikte, geometriyi doğru bir şekilde tasvir etmez. ⓘ
Konformasyon
Yapısal formül ve bağ açıları genellikle bir molekülün geometrisini tamamen tanımlamak için yeterli değildir. Her karbon-karbon bağı için bir serbestlik derecesi daha vardır: bağın her iki ucundaki atomlara bağlı atomlar veya gruplar arasındaki burulma açısı. Molekülün burulma açıları tarafından tanımlanan uzaysal düzenleme, molekülün konformasyonu olarak bilinir. ⓘ


Etan, alkanların konformasyonunu incelemek için en basit durumu oluşturur, çünkü sadece bir C-C bağı vardır. Eğer C-C bağının eksenine bakılırsa, Newman projeksiyonu olarak adlandırılan durum görülecektir. Hem ön hem de arka karbon atomları üzerindeki hidrojen atomları, tetrahedron tabanının düz bir düzlem üzerine izdüşümünden kaynaklanan 120°'lik bir açıya sahiptir. Bununla birlikte, ön karbona bağlı belirli bir hidrojen atomu ile arka karbona bağlı belirli bir hidrojen atomu arasındaki burulma açısı 0° ile 360° arasında serbestçe değişebilir. Bu, karbon-karbon tek bağı etrafında serbest dönüşün bir sonucudur. Bu görünür serbestliğe rağmen, sadece iki sınırlayıcı konformasyon önemlidir: tutulma konformasyonu ve kademeli konformasyon. ⓘ
İki konformasyon enerji bakımından farklılık gösterir: kademeli konformasyon, tutulma konformasyonundan (en az kararlı) 12,6 kJ/mol (3,0 kcal/mol) daha düşük enerjilidir (daha kararlı). ⓘ
Torsiyon enerjisi olarak bilinen iki konformasyon arasındaki bu enerji farkı, ortam sıcaklığındaki bir etan molekülünün termal enerjisine kıyasla düşüktür. C-C bağı etrafında sürekli bir dönme vardır. Bir etan molekülünün bir CH3 grubunun diğerine göre 120° dönmesine eşdeğer olan bir kademeli konformasyondan diğerine geçmesi için geçen süre 10-11 saniye mertebesindedir. ⓘ
Daha yüksek alkanların durumu daha karmaşıktır ancak her karbon-karbon bağı etrafında her zaman en çok tercih edilen antiperiplanar konformasyon ile benzer ilkelere dayanır. Bu nedenle, alkanlar genellikle diyagramlarda veya modellerde zikzak düzeninde gösterilir. Konformasyonlar arasındaki enerji farkları moleküllerin termal enerjisine kıyasla küçük olduğundan, gerçek yapı her zaman bu idealleştirilmiş formlardan biraz farklı olacaktır: Alkan molekülleri, modeller ne önerirse önersin, sabit bir yapısal forma sahip değildir. ⓘ
Spektroskopik özellikler
Neredeyse tüm organik bileşikler karbon-karbon ve karbon-hidrojen bağları içerir ve bu nedenle spektrumlarında alkanların bazı özelliklerini gösterirler. Alkanlar, başka hiçbir gruba sahip olmamaları ve dolayısıyla -OH, -CHO, -COOH vb. gibi fonksiyonel bir grubun diğer karakteristik spektroskopik özelliklerinin bulunmaması nedeniyle dikkate değerdir. ⓘ
Kızılötesi spektroskopisi
Karbon-hidrojen germe modu 2850 ve 2960 cm-1 arasında güçlü bir absorpsiyon verirken, karbon-karbon germe modu 800 ve 1300 cm-1 arasında absorpsiyon verir. Karbon-hidrojen bükme modları grubun doğasına bağlıdır: metil grupları 1450 cm-1 ve 1375 cm-1'de bantlar gösterirken, metilen grupları 1465 cm-1 ve 1450 cm-1'de bantlar gösterir. Dörtten fazla karbon atomuna sahip karbon zincirleri 725 cm-1 civarında zayıf bir absorpsiyon gösterir. ⓘ
NMR spektroskopisi
Alkanların proton rezonansları genellikle δH = 0.5-1.5'te bulunur. Karbon-13 rezonansları karbona bağlı hidrojen atomlarının sayısına bağlıdır: δC = 8-30 (birincil, metil, -CH3), 15-55 (ikincil, metilen, -CH2-), 20-60 (üçüncül, metilen, C-H) ve dördüncül. Kuaterner karbon atomlarının karbon-13 rezonansı, nükleer Overhauser etkisinin olmaması ve uzun gevşeme süresi nedeniyle karakteristik olarak zayıftır ve zayıf örneklerde veya yeterince uzun süre çalıştırılmamış örneklerde gözden kaçabilir. ⓘ
Kütle spektrometrisi
Alkanlar yüksek iyonlaşma enerjisine sahiptir ve moleküler iyon genellikle zayıftır. Parçalanma modelini yorumlamak zor olabilir, ancak dallı zincirli alkanlar söz konusu olduğunda, ortaya çıkan serbest radikallerin göreceli kararlılığı nedeniyle karbon zinciri tercihen üçüncül veya dördüncül karbonlarda parçalanır. Tek bir metil grubunun (M - 15) kaybından kaynaklanan parça genellikle yoktur ve diğer parçalar genellikle CH2 gruplarının ardışık kaybına karşılık gelen on dört kütle birimi aralıklarla yerleştirilir. ⓘ
Kimyasal özellikler
Alkanlar çoğu kimyasal bileşikle sadece zayıf bir şekilde reaktiftir. Tüm alkanların asit ayrışma sabiti (pKa) değerlerinin, ekstrapolasyon yöntemine bağlı olarak 50 ila 70 arasında değiştiği tahmin edilmektedir, bu nedenle bazlara karşı pratik olarak etkisiz olan son derece zayıf asitlerdir (bkz. karbon asitleri). Aynı zamanda son derece zayıf bazlardır, saf sülfürik asitte (H0 ~ -12) gözlemlenebilir bir protonasyona uğramazlar, ancak en az milyonlarca kat daha güçlü olan süper asitlerin hiperkoordinat alkanyum iyonları vermek için onları protonladığı bilinmektedir (bkz. metanyum iyonu). Benzer şekilde, yalnızca en güçlü elektrofilik reaktiflerle (örneğin, dioksiranlar ve NF4+ katyonu içeren tuzlar) reaktivite gösterirler. Güçlü C-H bağları (~100 kcal/mol) ve C-C bağları (~90 kcal/mol, ancak genellikle sterik olarak daha az erişilebilir) nedeniyle, serbest radikallere karşı da nispeten reaktif değildirler, ancak elektron eksikliği olan birçok radikal, diğer elektron bakımından zengin bağların yokluğunda alkanlarla reaksiyona girecektir (aşağıya bakınız). Bu inertlik, parafinler teriminin kaynağıdır ("afinite eksikliği" anlamında). Ham petrolde alkan molekülleri milyonlarca yıl boyunca kimyasal olarak değişmeden kalmıştır. ⓘ
Serbest radikaller, eşleşmemiş elektronlara sahip moleküller, uzun zincirli alkanların daha kısa zincirli alkanlara ve düz zincirli alkanların dallı zincirli izomerlere dönüştürüldüğü kraking ve reformasyon gibi alkanların çoğu reaksiyonunda büyük rol oynar. Ayrıca, alkanların serbest radikal ara ürünler içeren redoks reaksiyonları, özellikle oksijen ve halojenlerle, karbon atomları güçlü bir şekilde indirgenmiş durumda olduğundan mümkündür; metan durumunda, karbon mümkün olan en düşük oksidasyon durumundadır (-4). Oksijenle reaksiyon (eğer reaksiyon stokiyometrisini karşılayacak miktarda mevcutsa) dumansız yanmaya yol açarak karbondioksit ve su üretir. Halojenlerle serbest radikal halojenasyon reaksiyonları gerçekleşerek haloalkanların üretimine yol açar. Ayrıca, alkanların C-H bağı aktivasyon reaksiyonlarında belirli geçiş metal kompleksleri ile etkileşime girdiği ve bunlara bağlandığı gösterilmiştir. ⓘ
Çok dallanmış alkanlarda bağ açısı, hacimli grupları barındırmak için optimum değerden (109,5°) önemli ölçüde farklı olabilir. Bu tür çarpıtmalar molekülde sterik engel veya gerilme olarak bilinen bir gerilim yaratır. Gerilme reaktiviteyi önemli ölçüde artırır. ⓘ
Bununla birlikte, genel olarak ve belki de şaşırtıcı bir şekilde, dallanma oldukça elverişsiz 1,2- ve 1,3-alkil-alkil sterik etkileşimlerini (bütan ve pentanın tutulma konformasyonları durumunda sırasıyla ~3.1 kcal/mol ve ~3.7 kcal/mol değerinde) kaçınılmaz kılacak kadar kapsamlı olmadığında, dallanmış alkanlar aslında doğrusal (veya daha az dallanmış) izomerlerinden termodinamik olarak daha kararlıdır. Örneğin, yüksek oranda dallanmış 2,2,3,3-tetrametilbütan, doğrusal izomeri olan n-oktandan yaklaşık 1,9 kcal/mol daha kararlıdır. Bu etkinin inceliği nedeniyle, bu kuralın kesin nedenleri kimya literatüründe şiddetle tartışılmıştır ve henüz çözülmemiştir. Dallanmış alkanların elektron korelasyonu ile stabilizasyonu, lineer alkanların sterik itme ile destabilizasyonu, nötr hiperkonjugasyon ile stabilizasyon ve/veya elektrostatik etkiler gibi çeşitli açıklamalar olasılık olarak ileri sürülmüştür. Tartışma, hiperkonjugasyonun geleneksel açıklamasının alkil radikallerinin kararlılığını yöneten birincil faktör olup olmadığı sorusuyla ilgilidir. ⓘ
Oksijen ile reaksiyonlar (yanma reaksiyonu)
Karbon atomlarının sayısı arttıkça tutuşmaları giderek zorlaşsa da, tüm alkanlar bir yanma reaksiyonunda oksijenle reaksiyona girer. Tam yanma için genel denklem şöyledir:
- CnH2n+2 + (3/2n + 1/2) O2 → (n + 1) H2O + n CO2
- veya CnH2n+2 + (3n + 1/2) O2 → (n + 1) H2O + n CO2 ⓘ
Yeterli oksijen olmadığında, aşağıda gösterildiği gibi karbon monoksit ve hatta kurum oluşabilir:
Örneğin, metan:
- 2 CH4 + 3 O2 → 4 H2O + 2 CO
- CH4 + O2 → 2 H2O + C ⓘ
Ayrıntılı veriler için alkan oluşum ısısı tablosuna bakınız. Alkanlar için standart yanma entalpi değişimi, ΔcH⊖, CH2 grubu başına yaklaşık 650 kJ/mol artar. Dallı zincirli alkanlar, aynı sayıda karbon atomuna sahip düz zincirli alkanlardan daha düşük ΔcH⊖ değerlerine sahiptir ve bu nedenle biraz daha kararlı oldukları görülebilir. ⓘ
Halojenlerle reaksiyonlar
Alkanlar halojenlerle serbest radikal halojenasyon reaksiyonu olarak adlandırılan bir reaksiyona girer. Alkanın hidrojen atomları aşamalı olarak halojen atomlarıyla yer değiştirir. Serbest radikaller, genellikle bir ürün karışımına yol açan reaksiyona katılan reaktif türlerdir. Reaksiyon halojen flor ile oldukça ekzotermiktir ve bir patlamaya yol açabilir. ⓘ
Bu reaksiyonlar halojenli hidrokarbonlara giden önemli bir endüstriyel yoldur. Üç adım vardır:
- Halojen radikallerinin homoliz yoluyla oluşması. Genellikle ısı veya ışık şeklinde enerji gereklidir.
- Zincirleme reaksiyon veya Yayılma daha sonra gerçekleşir - halojen radikali bir alkil radikali vermek için alkan'dan bir hidrojen çıkarır. Bu daha fazla reaksiyona girer.
- Radikallerin yeniden birleştiği yerde zincir sonlanır. ⓘ
Deneyler, tüm halojenasyonun olası tüm izomerlerin bir karışımını ürettiğini göstermiştir, bu da tüm hidrojen atomlarının reaksiyona duyarlı olduğunu gösterir. Ancak üretilen karışım istatistiksel bir karışım değildir: İkincil ve üçüncül hidrojen atomları, ikincil ve üçüncül serbest radikallerin daha kararlı olması nedeniyle tercihen yer değiştirir. Bir örnek propanın monobrominasyonunda görülebilir:
Çatlama
Kırma, büyük molekülleri daha küçük moleküllere ayırır. Bu, termal veya katalitik bir yöntemle yapılabilir. Termal kraking işlemi, serbest radikallerin oluşumu ile homolitik bir mekanizma izler. Katalitik kraking işlemi, genellikle bir karbokatyon ve çok kararsız hidrit anyonu olmak üzere zıt yüklü iyon çiftleri veren bağların heterolitik (asimetrik) kırılmasını teşvik eden asit katalizörlerinin (genellikle silika-alümina ve zeolitler gibi katı asitler) varlığını içerir. Karbon lokalize serbest radikaller ve katyonların her ikisi de oldukça kararsızdır ve zincir yeniden düzenlenmesi, beta pozisyonunda C-C bölünmesi (yani çatlama) ve molekül içi ve moleküller arası hidrojen transferi veya hidrit transferi süreçlerinden geçer. Her iki süreç türünde de, ilgili reaktif ara ürünler (radikaller, iyonlar) sürekli olarak yenilenir ve böylece kendi kendine yayılan bir zincir mekanizması ile ilerlerler. Reaksiyon zinciri sonunda radikal veya iyon rekombinasyonu ile sonlandırılır. ⓘ
İzomerizasyon ve reformasyon
Dragan ve meslektaşı, alkanlarda izomerizasyon hakkında rapor veren ilk kişilerdir. İzomerizasyon ve reformasyon, düz zincirli alkanların platin katalizör varlığında ısıtıldığı süreçlerdir. İzomerizasyonda alkanlar dallı zincirli izomerler haline gelir. Başka bir deyişle, aynı moleküler ağırlığı koruyarak herhangi bir karbon veya hidrojen kaybetmez. Reformasyonda alkanlar sikloalkanlara veya aromatik hidrokarbonlara dönüşür ve yan ürün olarak hidrojen açığa çıkar. Bu işlemlerin her ikisi de maddenin oktan sayısını yükseltir. Bütan, yüksek oktan sayısına sahip birçok dallanmış alkan oluşturduğu için izomerizasyon işlemine tabi tutulan en yaygın alkandır. ⓘ
Diğer reaksiyonlar
Alkanlar, hidrojen vermek için nikel katalizör varlığında buharla reaksiyona girecektir. Alkanlar klorosülfonlanabilir ve nitratlanabilir, ancak her iki reaksiyon da özel koşullar gerektirir. Alkanların karboksilik asitlere fermantasyonu bazı teknik öneme sahiptir. Reed reaksiyonunda kükürt dioksit, klor ve ışık hidrokarbonları sülfonil klorürlere dönüştürür. Nükleofilik Soyutlama bir alkanı bir metalden ayırmak için kullanılabilir. Alkil grupları transmetalasyon reaksiyonları ile bir bileşikten diğerine aktarılabilir. Sihirli asit olarak adlandırılan antimon pentaflorür (SbF5) ve florosülfonik asit (HSO3F) karışımı alkanları protonlayabilir. ⓘ
Oluşum
Evrende alkanların oluşumu
Alkanlar, Jüpiter (%0,1 metan, 2 ppm etan), Satürn (%0,2 metan, 5 ppm etan), Uranüs (%1,99 metan, 2,5 ppm etan) ve Neptün (%1,5 metan, 1,5 ppm etan) gibi dış gaz gezegenlerinin atmosferlerinin küçük bir bölümünü oluşturur. Satürn'ün bir uydusu olan Titan (%1,6 metan), Huygens sondası tarafından incelenmiş ve Titan'ın atmosferinin periyodik olarak uydunun yüzeyine sıvı metan yağdırdığını göstermiştir. Ayrıca Titan'da Cassini görevi Titan'ın kutup bölgelerine yakın mevsimsel metan/etan göllerini görüntülemiştir. Hyakutake kuyruklu yıldızının kuyruğunda da metan ve etan tespit edilmiştir. Kimyasal analizler, etan ve metan bolluklarının kabaca eşit olduğunu göstermiştir; bu da buzlarının yıldızlararası uzayda, Güneş'ten uzakta oluştuğunu ve bu uçucu molekülleri buharlaştırmış olabileceğini düşündürmektedir. Alkanlar karbonlu kondritler gibi meteoritlerde de tespit edilmiştir. ⓘ
Dünya'da alkanların oluşumu
Dünya atmosferinde metan gazı izleri (yaklaşık %0,0002 veya 1745 ppb) bulunur ve öncelikle geviş getiren hayvanların bağırsaklarındaki Archaea gibi metanojenik mikroorganizmalar tarafından üretilir. ⓘ
Alkanlar için en önemli ticari kaynaklar doğal gaz ve petroldür. Doğal gaz öncelikle metan ve etan ile bir miktar propan ve bütan içerir: petrol ise sıvı alkanlar ve diğer hidrokarbonların bir karışımıdır. Bu hidrokarbonlar, deniz hayvanları ve bitkilerinin (zooplankton ve fitoplankton) ölüp eski denizlerin dibine çökmesi ve anoksik bir ortamda tortularla kaplanıp milyonlarca yıl boyunca yüksek sıcaklık ve yüksek basınç altında bugünkü hallerine dönüşmesiyle oluşmuştur. Doğal gaz bu şekilde, örneğin aşağıdaki reaksiyon sonucu ortaya çıkmıştır:
- C6H12O6 → 3 CH4 + 3 CO2 ⓘ
Geçirimsiz örtü kayalarının altında sıkışmış gözenekli kayalarda toplanan bu hidrokarbon yatakları ticari petrol sahalarını oluşturmaktadır. Milyonlarca yılda oluşmuşlardır ve bir kez tükendiklerinde kolay kolay yerine yenileri konulamaz. Bu hidrokarbon rezervlerinin tükenmesi, enerji krizi olarak bilinen durumun temelini oluşturmaktadır. ⓘ
Metan ayrıca biyogaz olarak adlandırılan, hayvanlar ve çürüyen maddeler tarafından üretilen ve olası bir yenilenebilir enerji kaynağı olan gazda da mevcuttur. ⓘ
Alkanların suda çözünürlüğü düşüktür, bu nedenle okyanuslardaki içeriği ihmal edilebilir düzeydedir; ancak yüksek basınçlarda ve düşük sıcaklıklarda (okyanusların dibinde olduğu gibi) metan, katı bir metan klatrat (metan hidrat) oluşturmak üzere suyla birlikte kristalleşebilir. Bu durumdan şu anda ticari olarak faydalanılamasa da, bilinen metan klatrat alanlarının yanıcı enerji miktarı, tüm doğal gaz ve petrol yataklarının enerji içeriğinin toplamından daha fazladır. Bu nedenle metan klatrattan çıkarılan metan, geleceğin yakıtları için bir adaydır. ⓘ
Biyolojik oluşum
Asiklik alkanlar doğada çeşitli şekillerde ortaya çıkar. ⓘ
- Bakteriler ve arkeler ⓘ

Bazı bakteri türleri alkanları metabolize edebilir: tek sayılı zincirlere göre daha kolay parçalandıkları için çift sayılı karbon zincirlerini tercih ederler. ⓘ
Öte yandan, bazı arkeler, metanojenler, karbondioksit veya diğer oksitlenmiş organik bileşiklerin metabolizması yoluyla büyük miktarlarda metan üretirler. Enerji, hidrojenin oksidasyonu ile açığa çıkar:
- CO2 + 4 H2 → CH4 + 2 H2O ⓘ
Metanojenler aynı zamanda sulak alanlardaki bataklık gazının da üreticileridir. Günde 30 ila 50 galon salınım yapabilen sığırların ve diğer otçulların ve termitlerin metan çıkışı da metanojenlerden kaynaklanmaktadır. Ayrıca insanların bağırsaklarında tüm alkanların bu en basitini üretirler. Dolayısıyla metanojenik arkeler karbon döngüsünün sonunda yer alır ve karbon fotosentezle sabitlendikten sonra atmosfere geri salınır. Mevcut doğal gaz yataklarımızın da benzer bir şekilde oluşmuş olması muhtemeldir. ⓘ
- Mantarlar ve bitkiler
Alkanlar üç ökaryotik organizma grubunun biyolojisinde de küçük de olsa bir rol oynar: mantarlar, bitkiler ve hayvanlar. Candida tropicale, Pichia sp., Rhodotorula sp. gibi bazı özel mayalar alkanları karbon veya enerji kaynağı olarak kullanabilir. Amorphotheca resinae mantarı uçak yakıtındaki uzun zincirli alkanları tercih eder ve tropikal bölgelerdeki uçaklar için ciddi sorunlara neden olabilir. ⓘ
Bitkilerde, katı uzun zincirli alkanlar birçok türün bitki kütikülünde ve epikütiküler mumunda bulunur, ancak nadiren ana bileşenlerdir. Bitkiyi su kaybına karşı korur, önemli minerallerin yağmurla süzülmesini önler ve bakteri, mantar ve zararlı böceklere karşı koruma sağlarlar. Bitki alkanlarındaki karbon zincirleri genellikle tek sayılıdır, 27 ila 33 karbon atomu uzunluğundadır ve bitkiler tarafından çift sayılı yağ asitlerinin dekarboksilasyonu ile yapılır. Balmumu tabakasının tam bileşimi sadece türe bağlı değildir, aynı zamanda mevsime ve aydınlatma koşulları, sıcaklık veya nem gibi çevresel faktörlere göre de değişir. ⓘ
Daha uçucu kısa zincirli alkanlar da bitki dokuları tarafından üretilir ve bu dokularda bulunur. Jeffrey çamı, reçinesinde olağanüstü yüksek seviyelerde n-heptan üretmesiyle tanınır, bu nedenle damıtığı bir oktan derecesi için sıfır noktası olarak belirlenmiştir. Çiçek kokularının da uzun zamandır uçucu alkan bileşenleri içerdiği bilinmektedir ve n-nonan bazı güllerin kokusunda önemli bir bileşendir. Bitkiler tarafından etan, pentan ve hekzan gibi gaz ve uçucu alkanların emisyonu da düşük seviyelerde belgelenmiştir, ancak bunlar genellikle biyojenik hava kirliliğinin önemli bir bileşeni olarak kabul edilmemektedir. ⓘ
Yenilebilir bitkisel yağlar da tipik olarak, kilogram başına düzinelerce miligrama kadar (ağırlıkça milyonda bir parça) ve bazen toplam alkan fraksiyonu için yüzün üzerinde konsantrasyonlarla, genellikle düşük ila üst 20'lerde zirve yapan, çoğunlukla 8 ila 35 olmak üzere geniş bir karbon sayısı spektrumuna sahip küçük biyojenik alkan fraksiyonları içerir. ⓘ
- Hayvanlar
Alkanlar, doymamış hidrokarbonlardan daha az önemli olmalarına rağmen hayvansal ürünlerde bulunur. Buna bir örnek, yaklaşık %14 pristan (2,6,10,14-tetrametilpentadekan, C19H40) içeren köpekbalığı karaciğer yağıdır. Böceklerin iletişim için bağımlı oldukları feromonlar, kimyasal haberci maddeler olarak önemlidirler. Bazı türlerde, örneğin destek böceği Xylotrechus colonus, pentakozan (C25H52), 3-metilpentaikozan (C26H54) ve 9-metilpentaikozan (C26H54) vücut teması ile aktarılır. Çeçe sineği Glossina morsitans morsitans gibi diğerlerinde feromon 2-metilheptadekan (C18H38), 17,21-dimetilheptatriakontan (C39H80), 15,19-dimetilheptatriakontan (C39H80) ve 15,19,23-trimetilheptatriakontan (C40H82) olmak üzere dört alkan içerir ve daha uzun mesafelerde koku yoluyla etki eder. Sallanarak dans eden bal arıları iki alkan, trikosan ve pentakosan üretir ve salar. ⓘ
Ekolojik ilişkiler

Hem bitki hem de hayvan alkanlarının rol oynadığı bir örnek, kum arısı (Andrena nigroaenea) ve erken örümcek orkidesi (Ophrys sphegodes) arasındaki ekolojik ilişkidir; ikincisi tozlaşma için birincisine bağımlıdır. Kum arıları eşlerini belirlemek için feromon kullanırlar; A. nigroaenea örneğinde dişiler 3:3:1 oranında trikosan (C23H48), pentakosan (C25H52) ve heptakosan (C27H56) karışımı yayarlar ve erkekler özellikle bu kokudan etkilenirler. Orkide, erkek arının polenlerini toplamasını ve yaymasını sağlamak için bu çiftleşme düzenlemesinden yararlanır; çiçeğinin parçaları sadece kum arılarının görünümüne benzemekle kalmaz, aynı zamanda dişi kum arılarıyla aynı oranda büyük miktarlarda üç alkan üretir. Sonuç olarak, çok sayıda erkek çiçeklere çekilir ve hayali partnerleriyle çiftleşmeye çalışır: bu çaba arı için başarı ile taçlandırılmasa da, orkidenin polenlerini aktarmasını sağlar, Sinirli erkeğin ayrılmasından sonra diğer çiçeklere dağılacaktır. ⓘ
Üretim
Petrol rafinasyonu

Daha önce de belirtildiği gibi, alkanların en önemli kaynağı doğal gaz ve ham petroldür. Alkanlar bir petrol rafinerisinde fraksiyonel damıtma yoluyla ayrıştırılır ve birçok ürüne dönüştürülür. ⓘ
Fischer-Tropsch
Fischer-Tropsch süreci, karbon monoksit ve hidrojenden alkanlar da dahil olmak üzere sıvı hidrokarbonları sentezlemek için kullanılan bir yöntemdir. Bu yöntem, petrol damıtıklarının yerine ikame ürünler üretmek için kullanılır. ⓘ
Laboratuvar hazırlığı
Alkanların laboratuvarda sentezlenmesine genellikle çok az ihtiyaç vardır, çünkü genellikle ticari olarak temin edilebilirler. Ayrıca, alkanlar genellikle kimyasal veya biyolojik olarak reaktif değildir ve fonksiyonel gruplar arası dönüşümlerden temiz bir şekilde geçmezler. Alkanlar laboratuvarda üretildiğinde, genellikle bir reaksiyonun yan ürünüdür. Örneğin, n-bütilityumun güçlü bir baz olarak kullanılması, eşlenik asit olan n-bütanı bir yan ürün olarak verir:
- C4H9Li + H2O → C4H10 + LiOH ⓘ
Bununla birlikte, bazen yukarıdaki veya benzer yöntemler kullanılarak bir molekülün bir bölümünün alkan benzeri bir işlevselliğe (alkil grubu) dönüştürülmesi istenebilir. Örneğin, bir etil grubu bir alkil grubudur; bu bir hidroksi grubuna bağlandığında, bir alkan olmayan etanol verir. Bunu yapmak için, en iyi bilinen yöntemler alkenlerin hidrojenasyonudur:
- RCH=CH2 + H2 → RCH2CH3 (R = alkil) ⓘ
Alkanlar veya alkil grupları Corey-House-Posner-Whitesides reaksiyonunda doğrudan alkil halojenürlerden de hazırlanabilir. Barton-McCombie deoksijenasyonu alkollerden hidroksil gruplarını uzaklaştırır, örn.
ve Clemmensen indirgemesi aldehit ve ketonlardan karbonil gruplarını uzaklaştırarak alkanlar veya alkil ikameli bileşikler oluşturur, örn:
Diğer organik bileşiklerden hazırlama
Alkanlar çeşitli organik bileşiklerden hazırlanabilir. Bunlar arasında alkenler, alkinler, haloalkanlar, alkoller, aldehitler, ketonlar ve karboksilik asitler bulunur. ⓘ
Alkenler ve alkinlerden
Alkenlerin ve alkinlerin π bağları boyunca moleküler hidrojen eklenmesi alkanları verir. Bu hidrojenasyon reaksiyonu tipik olarak paladyum, platin veya nikel gibi toz metal bir katalizör kullanılarak gerçekleştirilir. Reaksiyon ekzotermiktir çünkü ürün alkan daha kararlıdır. Bu, endüstriyel ve araştırma kimyasının çeşitli alanlarında önemli bir süreçtir. ⓘ
Haloalkanlardan
Çeşitli yöntemler haloalkanlardan alkanlar üretir. ⓘ
Wurtz reaksiyonunda, bir haloalkan kuru eter içinde sodyum ile muamele edilerek karbon atomu sayısının iki katına sahip bir alkan elde edilir. Bu reaksiyon bir serbest radikal ara maddesi üzerinden ilerler ve üçüncül haloalkanlar ve vicinal dihalidler durumunda alken oluşumu olasılığı vardır. ⓘ
- 2 R-X + 2 Na → R-R + 2 Na+X ⓘ
Corey-House sentezinde bir haloalkan, bir Gilman reaktifi olan dialkil lityum kuprat ile muamele edilerek daha yüksek bir alkan elde edilir:
- Li+[R-Cu-R]- + R'-X → R-R' + R-Cu + Li+X ⓘ
Haloalkanlar, lityum alüminyum hidrit gibi hidrit reaktifleri ile reaksiyona sokularak alkanlara indirgenebilir. ⓘ
- R-X + H- → R-H + X- ⓘ
Uygulamalar
Alkanların uygulamaları karbon atomu sayısına bağlıdır. İlk dört alkan esas olarak ısıtma ve pişirme amacıyla ve bazı ülkelerde elektrik üretimi için kullanılır. Metan ve etan doğal gazın ana bileşenleridir; normalde basınç altında gaz olarak depolanırlar. Ancak bunları sıvı olarak taşımak daha kolaydır: Bunun için gazın hem sıkıştırılması hem de soğutulması gerekir. ⓘ
Propan ve bütan atmosferik basınçta bulunan gazlardır ve oldukça düşük basınçlarda sıvılaştırılabilirler ve genellikle sıvılaştırılmış petrol gazı (LPG) olarak bilinirler. Propan, propan gazı brülörlerinde ve karayolu taşıtlarında yakıt olarak, bütan ise uzay ısıtıcılarında ve tek kullanımlık sigara çakmaklarında kullanılır. Her ikisi de aerosol spreylerde itici gaz olarak kullanılır. ⓘ
Pentandan oktana kadar olan alkanlar oldukça uçucu sıvılardır. İçten yanmalı motorlarda yakıt olarak kullanılırlar, çünkü yanma odasına girdiklerinde yanmanın homojenliğini bozacak damlacıklar oluşturmadan kolayca buharlaşırlar. Dallı zincirli alkanlar, düz zincirli homologlarına göre vuruntuya neden olan erken tutuşmaya çok daha az eğilimli oldukları için tercih edilirler. Bu erken tutuşma eğilimi yakıtın oktan derecesi ile ölçülür, burada 2,2,4-trimetilpentan (izooktan) keyfi olarak 100 değerine sahiptir ve heptan ise sıfır değerine sahiptir. Yakıt olarak kullanımlarının yanı sıra, orta alkanlar polar olmayan maddeler için de iyi çözücülerdir. ⓘ
Nonandan hekzadekana (on altı karbon atomlu bir alkan) kadar olan alkanlar daha yüksek viskoziteli sıvılardır ve benzinde kullanım için giderek daha az uygundurlar. Bunun yerine dizel ve havacılık yakıtlarının büyük bir kısmını oluştururlar. Dizel yakıtlar setan sayıları ile karakterize edilir, setan hekzadekan için eski bir isimdir. Ancak bu alkanların daha yüksek erime noktaları düşük sıcaklıklarda ve yakıtın düzgün akamayacak kadar kalınlaştığı kutup bölgelerinde sorunlara neden olabilir. ⓘ
Hekzadekandan yukarı doğru olan alkanlar akaryakıt ve yağlama yağının en önemli bileşenlerini oluşturur. İkinci işlevde, hidrofobik yapıları suyun metal yüzeyine ulaşamayacağı anlamına geldiğinden, aynı zamanda anti-korozif maddeler olarak da çalışırlar. Birçok katı alkan, örneğin mumlarda parafin mumu olarak kullanım alanı bulur. Ancak bu, esas olarak esterlerden oluşan gerçek balmumu ile karıştırılmamalıdır. ⓘ
Yaklaşık 35 veya daha fazla karbon atomu zincir uzunluğuna sahip alkanlar, örneğin yol kaplamasında kullanılan bitümde bulunur. Bununla birlikte, yüksek alkanların çok az değeri vardır ve genellikle çatlama ile daha düşük alkanlara ayrılırlar. ⓘ
Polietilen ve polipropilen gibi bazı sentetik polimerler yüzlerce veya binlerce karbon atomu içeren zincirlere sahip alkanlardır. Bu malzemeler sayısız uygulamada kullanılmaktadır ve her yıl milyarlarca kilogram bu malzemelerden üretilmekte ve kullanılmaktadır. ⓘ
Çevresel dönüşümler
Alkanlar, organik bileşikler olarak çok reaktif olmayan, kimyasal olarak çok inert apolar moleküllerdir. Bu hareketsizlik, çevreye salınmaları halinde ciddi ekolojik sorunlara yol açar. Fonksiyonel gruplarının olmaması ve düşük suda çözünürlükleri nedeniyle alkanlar mikroorganizmalar için zayıf biyoyararlanım gösterirler. ⓘ
Bununla birlikte, n-alkanları hem karbon hem de enerji kaynağı olarak kullanabilecek metabolik kapasiteye sahip bazı mikroorganizmalar vardır. Bazı bakteri türleri alkanları ayrıştırma konusunda oldukça uzmanlaşmıştır; bunlar hidrokarbonoklastik bakteriler olarak adlandırılır. ⓘ
Tehlikeler
Metan yanıcı, patlayıcı ve solunması tehlikelidir; renksiz, kokusuz bir gaz olduğu için metan çevresinde özel dikkat gösterilmelidir. Etan da son derece yanıcı, patlayıcı ve solunması tehlikelidir. Her ikisi de boğulmaya neden olabilir. Propan da yanıcı ve patlayıcıdır ve solunduğunda uyuşukluğa veya bilinç kaybına neden olabilir. Bütan da propan ile aynı tehlikeleri taşır. ⓘ
Alkanlar da çevre için tehdit oluşturur. Dallanmış alkanlar, dallanmamış alkanlara göre daha düşük biyolojik parçalanabilirliğe sahiptir. Atmosferdeki metan miktarı nispeten düşük olmasına rağmen, metan çevre için en tehlikeli sera gazı olarak kabul edilir. ⓘ
Dallanmamış alkanlar
Hidrokarbon zincirindeki karbon atomlarının en fazla iki karbon atomuyla yapmış olduğu moleküllere dallanmamış alkan denir. Dallanmamış alkanların yapısında sadece birincil ve ikincil karbon atomları bulunur. Dallanmamış alkanlar homolog bir sıra oluştururlar. ⓘ
Aşağıdaki tabelada ilk 14 n-Alkanın çeşitli fiziksel özelliklerini görebilmekteyiz. ⓘ
| C | Adı | Kimyasal formül | Yanma noktası | Erime noktası | Kaynama noktası | Özkütle | [Top-Çubuk modeli] ⓘ |
|---|---|---|---|---|---|---|---|
| 1 | Metan | CH4 | – | 90,65 K | 111,4 K | 0,667 kg/m³ | |
| 2 | Etan | C2H6 | – | 90 K | 185 K | 1,212 kg/m³ | |
| 3 | Propan | C3H8 | – | 85 K | 231 K | 1,83 kg/m³ | |
| 4 | n-Bütan | C4H10 | – | 135 K | 272,5 K | 2,703 kg/m³ | |
| 5 | n-Pentan | C5H12 | 224 K | 144 K | 309 K | 0,626 g/cm³ | |
| 6 | n-Heksan | C6H14 | 250 K | 178 K | 342 K | 0,659 g/cm³ | |
| 7 | n-Heptan | C7H16 | 269 K | 182 K | 371 K | 0,684 g/cm³ | |
| 8 | n-Oktan | C8H18 | 289 K | 216 K | 399 K | 0,703 g/cm³ | |
| 9 | n-Nonan | C9H20 | 304 K | 222 K | 424 K | 0,718 g/cm³ | |
| 10 | n-Dekan | C10H22 | 319 K | 243 K | 447 K | 0,73 g/cm³ | |
| 11 | n-Undekan | C11H24 | 333 K | 248 K | 469 K | 0,74 g/cm³ | |
| 12 | n-Dodekan | C12H26 | 344 K | 263 K | 489 K | 0,75 g/cm³ |
Dallanmış alkanlar
Karbon atomunun bileşikteki sayısının artmasıyla, kovalent bağlarla birbirine bağlı olan atomların oluşturabileceği molekül, yapısal olarak çeşitlilik göstermektedir. Bu yüzden Karbon sayısı yüksek olan alkanlar karşımıza molekül formülleri aynı olmasına rağmen farklı yapılarla çıkmaktadırlar. Böyle bileşiklere yapı izomerleri denilmektedir. ⓘ
Molekül formülü C4H10 olan bütan’da iki farklı yapıya rastlamaktayız. Bunlar n-bütan ve izo-bütan’dır. ⓘ
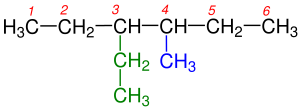
Pentan üç farklı izomeri yapısıyla karşımıza çıkmaktadır.Pentanın izomer yapıları şunlardır: Bir zincir şeklinde ve dallanmamış yapısıyla n-Pentan, diğeri ikici Karbon atomunda tek bir dallanma gösteren yapısıyla izo-Pentan ve son olarak ikinci Karbonunda ikili dallanma gösteren neo-Pentan denir. ⓘ
Karbon sayısının artmasıyla yapı izomerilerinin sayısı artmaktadır. ⓘ
| Dallanmış Bazı Alkanlarda İsomeri Çeşitleri (Çubuk Modeli) ⓘ | |||
|---|---|---|---|
| Genel Adı | n- | izo- | neo- |
| Propan | Bulunmamaktadır | Bulunmamaktadır | |
| Bütan | Bulunmamaktadır | ||
| Pentan | |||
Sikloalkanlar

Sikloalkanlar dairesel yapı gösteren doymuş hidrojen ve karbonlardan oluşan bileşiklerdir. Sikloalkanlar aynı zamanda dallanma gösterebilirler. Dallanmamış sikloalkanların genel formülü CnH2n şeklinde olup homolog bir yapı oluştururlar. Burada n ≥ 3 şartı vardır. ⓘ
Adlandırma
19 yüzyılın sonlarına kadar organik kimyada yapılan adlandırmalarda genelde o bileşiğin kaynağını ya da kullanıldığı yeri belirtecek şekilde olmaktaydı. Bu eski isimler diğer bir deyişle yaygın isimler günümüzde halen ticarette kimyacılar ve organik kimyacılar tarafından kullanılmaktadır. Bu nedenle bazı bileşiklerin yaygın isimlerinin bilinmesi zorunludur. ⓘ
Günümüzde kullanılan sistem 1892’de Uluslararası Teorik ve Uygulamalı Kimya Birliği (IUPAC) tarafından önerilen bir sistemdir. Bu sistemde temel prensip her maddenin farklı bir isim alması üzerinedir. Bu yolla yedi milyar organik bileşik adlandırılmış ve ayrıca daha milyonlarca bileşiğin adlandırılmasına olanak vermektedir. ⓘ
Dallanmamış alkanlarda adlandırma
Dallanmamış alkanlarda adlandırma yapılırken Hidrokarbon zincirindeki karbon sayısının latincedeki karşılığı alınıp sonuna –an takısının takılmasıyla yapılmaktadır. Aşağıdaki tabloda ilk 20 n-Alkanın Kimyasal(Genel) formüllerini ve IUPAC Adlandırmadaki isimlerini görebiliriz. ⓘ
| Dallanmamış Alkanlarda IUPAC Adlandrılması ⓘ | |||
|---|---|---|---|
| Genel Formülü | IUPAC Adı | Genel Formülü | IUPAC Adı |
| CH4 | Metan | C11H24 | Undekan |
| C2H6 | Etan | C12H26 | Dodekan |
| C3H8 | Propan | C13H28 | Tridekan |
| C4H10 | Bütan | C14H30 | Tetradekan |
| C5H12 | Pentan | C15H32 | Pentadekan |
| C6H14 | Heksan | C16H34 | Heksadekan |
| C7H16 | Heptan | C17H36 | Heptadekan |
| C8H18 | Oktan | C18H38 | Oktadekan |
| C9H20 | Nonan | C19H40 | Nanodekan |
| C10H22 | Dekan | C20H42 | Eiokoskan |
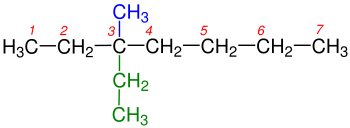
Dallanmış alkanlarda adlandırma
Alkanlarda en uzun karbon zinciri üzerinde başka bir grup bağlanmışsa buna dallanma denir ve sistematik adlandırmada belirtilmelidir. Dallanmış Alkanlarda adlandırma yapılırken dikkat edilecek kurallar aşağıda belirtilmiştir. ⓘ
| Dallanmış Alkanların Adlandırılmasında Dikkat Edilecek Hususlar ⓘ | ||
| 1 | ||
| 1a) | 1b) | |
| 2 | ||
| 2a) Maviyle İşaretlenmiş kısım Sübtitüent grubudur. | 2b)Maviyle İşaretlenmiş kısım Sübtitüent grubudur. | |
| 3 | ||
| 3a) 2-Metilheksan | 3b) 3-Metilheptan | |
| 4 | ||
| 4a) 3-Etil-4-metilheksan | 4b) 4-Etil-3-metilheksan | |
| 5 | ||
| 5a) 3-Etil-3-metilheksan | 5b) 3-Etil-3-metilheptan | |
| 6 | ||
| 6a) 2,2,4,4-Tetrametilheksan | 6b) 2,2,4-Trimetilheptan | |
| 7 | ||
| 7a) 2,4,5-Trimetil-3-propilheksan | 7b) 2,3,4,6-Tetrametil-5-propilheptan | |
| 8 | ||
| 8a) 2,3,5-Trimetilheksan | 8b) 2,3,6-Trimetilheptan | |
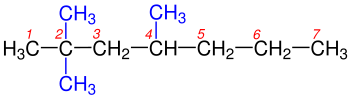
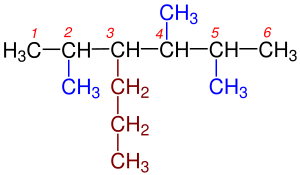
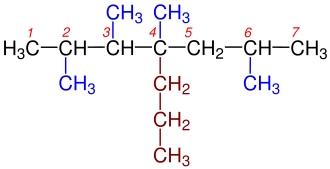
1- Dallanmaya uğramış en uzun karbon zinciri bulunur.Yandaki tabloda da görüldüğü gibi 1a kutusundaki Hidrokarbonzincirinde en uzun karbon zincirini bulmak o kadar zor değildir, çünkü iki eşit uzunluğundaki karbon zincirinden oluşmaktadır.Bu iki zincir arasında istediğimizi seçebiliriz. Yalnız 1b kutusundaki Hidrokarbon zincirinde biri 6 diğeri 7 karbondan olmak üzeri iki farklı uzunluğtaki karbon zincirinden oluşmaktadır. Bize gerekli olan en uzun zincir olduğundan 7 karbonlu olan seçilir. ⓘ
2- Dallanmış grublara Sübstitüen denilmektedir.Hidrokarbon zinciri üzerinde bulunun karbonlar numaralandırılır. Numaralandırma yapılırken sübstitüent grubuna en yakın uçtan başlanılır.Yandaki tabloda 2a ve 2b'de gördüğümüz gibi numaralandırma yapılırken Karbon zincirinin sağından ya da solundan başlamak önemli değildir. Burada önemli olan Sübstitüent grubuna en yakın uçtan başlamaktır. ⓘ
3- Alkanlardan bir hidrojenin koparılmasıyla Alkiller oluşur. Yani en basit Alkan olan Metandan (CH4) bir hidrojenin uzaklaştırılmasıyla Metil (CH3), etandan (C2H8) bir hidrojen koparılırsa etil (C2H7), propandan(C3H8) bir hidrojenin uzaklaştırılmasıyla propil(C3H7) vb. oluşur. Bu Alkil grupları adlandırılma yapılırken yerleri belirtilmelidirler. Bu yüzden Alkil grubu diğer bir deyişle Sübstitüentlerin yerini belirten rakam ve isim arasına eksi(-) işareti koyularak yazılır. ⓘ
4- Eğer bir Karbon zinciri üzerinde birden fazla Sübstitüent diğer bir deyişle alkil grubu varsa bunların yerleri en uzun karbon zinciri üzerinden belirlenir ve alfabetik sıralanma göz önünde bulundurularak yazılır. Yazılırken alkil grupları arasına eksi (-) işareti konularak birbirlerinden ayrı yazılır. ⓘ
5- Aynı karbon üzerinde iki tane sübstitüent varsa bunların numarası iki defa kullanılır. ⓘ
6- En uzun karbon zincirinin üzerinde iki veya daha fazla sübstitüent varsa bunların sayıları di-, tri-, tetra-, penta-, şeklinde belirtilerek adın önüne yazılır. ⓘ
7- Eğer Karbonhidrad zinciri iki eşit uzunluktaki zincirden oluşuyorsa üzerinde en fazla sübstitüent bulunan zincir seçilir. En sonunada en uzun karbon zincirindeki alkanın adı yazılır. ⓘ
8- Eğer Karbonhidrat zincirindeki ilk dallanmalar her iki uca da eşit uzaklıktaysa,numaralandırma yapılırken rakamların toplamı en az olan numaralandırma seçilir. ⓘ
Alkanların doğadaki kaynakları
Damıtma yöntemi
Petrol saf madde olmayan bir karışımdır. Bu yüzden içindeki maddeler çeşitli kaynama noktalarına sahiptirler. Rafinelilerde bu yöntem kullanılarak petrolden çeşitli ürünler elde edilmektedir. Bu yöntemle Petrol çeşitli sıcaklıklara kadar ısıtılarak içeriğindeki maddeler ilk etapta buharlaştırılıp ve daha sonra yoğunlaştırılarak birbirlerinden ayrıştırılır. Bununla elde edilecek bir maddenin miktarı o maddenin karışım içindeki miktarıyla sınırlıdır. ⓘ
Kraking
Petrol sanayisinin gelişmesiyle bazı petrol ürünlerine olan ihtiyacı artırmıştır. Bu yöntem kullanılarak petrolden ihtiyaca göre maddeler elde etme mümkündür. Katalizatörlerin ve ısının yardımıyla uzun Hidrokarbon zincirleri kırılarak daha küçük ve az dallanmış alkanlara çevrilmektedir. Bu işlem katalizatörsüzde yapılabilmektedir. Ancak katalizatörsüz yapılan işlemde düz zincirler halindeki alkanlar oluşmaktadır. Buda oktan bakımından zayıf kalmasına sebep olmakla beraber tercih edilmeyen bir işlemdir. ⓘ