Benzen
| |||
 Boşluk doldurma modeli
| |||
| İsimler | |||
|---|---|---|---|
| Tercih edilen IUPAC adı
Benzen | |||
| Diğer isimler
Benzol (tarihi/Almanca)
Cyclohexa-1,3,5-triene; 1,3,5-Cyclohexatriene [6]Annulene (tavsiye edilmez) | |||
| Tanımlayıcılar | |||
CAS Numarası
|
|||
3D model (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| EC Numarası |
| ||
| KEGG | |||
PubChem CID
|
|||
| RTECS numarası |
| ||
| UNII | |||
InChI
| |||
GÜLÜMSEMELER
| |||
| Özellikler | |||
Kimyasal formül
|
C6H6 | ||
| Molar kütle | 78.114 g-mol-1 | ||
| Görünüş | Renksiz sıvı | ||
| Koku | tatlı aromatik | ||
| Yoğunluk | 0,8765(20) g/cm3 | ||
| Erime noktası | 5,53 °C (41,95 °F; 278,68 K) | ||
| Kaynama noktası | 80,1 °C (176,2 °F; 353,2 K) | ||
Suda çözünürlük
|
1,53 g/L (0 °C) 1,81 g/L (9 °C) 1,79 g/L (15 °C) 1,84 g/L (30 °C) 2,26 g/L (61 °C) 3,94 g/L (100 °C) 21,7 g/kg (200 °C, 6,5 MPa) 17,8 g/kg (200 °C, 40 MPa) | ||
| Çözünürlük | Alkol, CHCl3, CCl4, dietil eter, aseton, asetik asit içinde çözünür | ||
| Etanediol içinde çözünürlük | 5,83 g/100 g (20 °C) 6,61 g/100 g (40 °C) 7,61 g/100 g (60 °C) | ||
| Etanol içinde çözünürlük | 20 °C, su içinde çözelti: 1,2 mL/L (%20 v/v) | ||
| Aseton içinde çözünürlük | 20 °C, su içinde çözelti: 7,69 mL/L (%38,46 v/v) 49,4 mL/L (%62,5 v/v) | ||
| Dietilen glikol içinde çözünürlük | 52 g/100 g (20 °C) | ||
| log P | 2.13 | ||
| Buhar basıncı | 12,7 kPa (25 °C) 24,4 kPa (40 °C) 181 kPa (100 °C) | ||
| Konjugat asit | Benzenium | ||
| UV-vis (λmax) | 255 nm | ||
Manyetik duyarlılık (χ)
|
-54,8-10-6 cm3/mol | ||
Kırılma indisi (nD)
|
1.5011 (20 °C) 1.4948 (30 °C) | ||
| Viskozite | 0,7528 cP (10 °C) 0,6076 cP (25 °C) 0,4965 cP (40 °C) 0,3075 cP (80 °C) | ||
| Yapı | |||
Moleküler şekil
|
Trigonal düzlemsel | ||
Dipol moment
|
0 D | ||
| Termokimya | |||
Isı kapasitesi (C)
|
134,8 J/mol-K | ||
Std molar
entropi (S |
173,26 J/mol-K | ||
Std entalpi
oluşumu (ΔfH⦵298) |
48,7 kJ/mol | ||
Std entalpi
yanma (ΔcH⦵298) |
-3267,6 kJ/mol | ||
| Tehlikeler | |||
| İş güvenliği ve sağlığı (OHS/OSH): | |||
Ana tehlikeler
|
potansiyel mesleki kanserojen, yanıcı | ||
| GHS etiketlemesi: | |||
Piktogramlar
|
    
| ||
Sinyal kelimesi
|
Tehlike | ||
Tehlike bildirimleri
|
H225, H302, H304, H305, H315, H319, H340, H350, H372, H410 | ||
Önlem ifadeleri
|
P201, P210, P301+P310, P305+P351+P338, P308+P313, P331 | ||
| NFPA 704 (yangın elması) | |||
| Parlama noktası | -11,63 °C (11,07 °F; 261,52 K) | ||
Otomatik ateşleme
sıcaklık |
497,78 °C (928,00 °F; 770,93 K) | ||
| Patlayıcı limitleri | 1.2–7.8% | ||
| Öldürücü doz veya konsantrasyon (LD, LC): | |||
LD50 (medyan doz)
|
80,8 mg/kg (sıçan, oral) | ||
LCLo (yayınlanan en düşük)
|
44.000 ppm (tavşan, 30 dakika) 44,923 ppm (köpek) 52,308 ppm (kedi) 20.000 ppm (insan, 5 dakika) | ||
| NIOSH (ABD sağlık maruziyet limitleri): | |||
PEL (İzin Verilebilir)
|
TWA 1 ppm, ST 5 ppm | ||
REL (Önerilen)
|
Ca TWA 0,1 ppm ST 1 ppm | ||
IDLH (Acil tehlike)
|
500 ppm | ||
| Güvenlik bilgi formu (SDS) | HMDB | ||
| İlgili bileşikler | |||
İlgili bileşikler
|
Toluen Borazin | ||
Aksi belirtilmedikçe, veriler standart durumdaki malzemeler için verilmiştir (25 °C [77 °F], 100 kPa'da).
Bilgi kutusu referansları
| |||
Benzen, C6H6 moleküler formülüne sahip organik bir kimyasal bileşiktir. Benzen molekülü, her birine bir hidrojen atomu bağlı düzlemsel bir halkada birleştirilmiş altı karbon atomundan oluşur. Sadece karbon ve hidrojen atomları içerdiğinden, benzen bir hidrokarbon olarak sınıflandırılır. ⓘ
Benzen ham petrolün doğal bir bileşenidir ve temel petrokimyasallardan biridir. Karbon atomları arasındaki döngüsel sürekli pi bağları nedeniyle benzen aromatik bir hidrokarbon olarak sınıflandırılır. Bazen PhH olarak kısaltılır. Benzen renksiz ve oldukça yanıcı bir sıvı olup tatlı bir kokuya sahiptir ve benzin istasyonlarının etrafındaki aromadan kısmen sorumludur. Öncelikle, yılda milyarlarca kilogram üretilen etilbenzen ve kümen gibi daha karmaşık yapıya sahip kimyasalların üretiminde öncü olarak kullanılır. Önemli bir endüstriyel kimyasal olmasına rağmen benzen, toksisitesi nedeniyle tüketici ürünlerinde sınırlı kullanım alanı bulmaktadır. ⓘ

Benzen, aren veya aromatik hidrokarbonlar olarak adlandırılan organik bileşikler sınıfının en basit üyesidir. Renksiz, alevlenebilen, kaynama noktası 80,1 °C, erime noktası 5,5 °C olan bir sıvıdır. Moleküler formülü C6H6'dır. Benzen, endüstriyel bakımdan kıymetli olduğu gibi yapısı bakımından da kimya çalışmalarında önemlidir. Kan hücrelerini öldürme etkisi olduğundan kanser yapan bileşikler arasına girer. Eskiden balina yağının ısı etkisiyle bozunmasından elde edilen gaz, basınçla evlere gönderilir ve aydınlatmada kullanılırdı. Bu gazdan yağımsı bir kısım kalırdı. Benzen, 1825 yılında Michael Faraday tarafından bu yağımsı kısımda keşfedildi. Yaklaşık sekiz sene sonra başka araştırmacılar aynı maddeyi benzoik asidin kireçle oksidasyonundan elde ettiler. 1845'te August Wilhelm von Hofmann benzen diye adlandırdığı aynı maddeyi elde etmek için kömür katranı kullandı. ⓘ

Tarihçe
Keşif
"Benzen" kelimesi, 16. yüzyıldan beri Avrupalı eczacılar ve parfümcüler tarafından güneydoğu Asya'nın bir ürünü olarak bilinen aromatik bir reçine olan "gum benzoin "den (benzoin reçinesi) türemiştir. Benzoinden süblimasyon yoluyla asidik bir madde elde edilmiş ve "benzoin çiçeği" ya da benzoik asit olarak adlandırılmıştır. Benzoik asitten türetilen hidrokarbon böylece benzin, benzol veya benzen adını almıştır. Michael Faraday benzeni ilk kez 1825 yılında aydınlatıcı gaz üretiminden elde edilen yağlı kalıntıdan izole edip tanımladı ve ona hidrojenin bikarbüreti adını verdi. 1833 yılında Eilhard Mitscherlich benzoik asit (benzoin sakızından) ve kireci damıtarak benzeni üretti. Bileşiğe benzin adını verdi. 1836'da Fransız kimyager Auguste Laurent maddeye "phène" adını verdi; bu kelime hidroksillenmiş benzen olan İngilizce "phenol" ve benzenden bir hidrojen atomunun (serbest radikal H-) soyutlanmasıyla oluşan radikal olan "phenyl" kelimelerinin kökü haline geldi. ⓘ

1845 yılında Charles Mansfield, August Wilhelm von Hofmann'ın yanında çalışarak kömür katranından benzen izole etti. Dört yıl sonra Mansfield, kömür katranı yöntemine dayanan ilk endüstriyel ölçekli benzen üretimine başladı. Yavaş yavaş, kimyagerler arasında bir dizi maddenin kimyasal olarak benzenle ilişkili olduğu ve çeşitli bir kimyasal aile oluşturduğu duygusu gelişti. Hofmann, 1855'te bu aile ilişkisini tanımlamak için, birçok üyesinin karakteristik bir özelliğinden sonra "aromatik" kelimesini kullandı. 1997 yılında uzayın derinliklerinde benzen tespit edilmiştir. ⓘ
Halka formülü

Benzen için ampirik formül uzun zamandır biliniyordu, ancak her karbon atomu için sadece bir hidrojen atomu içeren yüksek oranda çoklu doymamış yapısını belirlemek zordu. Archibald Scott Couper 1858'de ve Johann Josef Loschmidt 1861'de birden fazla çift bağ veya birden fazla halka içeren olası yapılar önerdiler, ancak o zamanlar kimyagerlerin herhangi bir yapı üzerinde karar vermelerine yardımcı olacak çok az kanıt mevcuttu. ⓘ
1865'te Alman kimyager Friedrich August Kekulé Fransızca bir makale yayınladı (çünkü o sırada Frankofon Belçika'da ders veriyordu) ve yapının tek ve çift bağları dönüşümlü olarak içeren altı karbon atomlu bir halka içerdiğini öne sürdü. Ertesi yıl aynı konuda Almanca olarak çok daha uzun bir makale yayınladı. Kekulé, önerdiği yapıyı desteklemek için aradan geçen yıllarda biriken kanıtları, yani benzenin herhangi bir monoderivatifinin her zaman yalnızca bir izomeri olduğu ve her sübstitüe türevinin her zaman tam olarak üç izomeri olduğu -şimdi aren sübstitüsyonunun orto, meta ve para modellerine karşılık geldiği anlaşılmaktadır- kullandı. Kekulé'nin simetrik halkası bu ilginç gerçeklerin yanı sıra benzenin 1:1 karbon-hidrojen oranını da açıklayabilir. ⓘ
Benzen ve dolayısıyla tüm aromatik bileşikler hakkındaki yeni anlayış, hem saf hem de uygulamalı kimya için o kadar önemli oldu ki, 1890 yılında Alman Kimya Derneği, ilk benzen makalesinin yirmi beşinci yıldönümünü kutlamak için Kekulé'nin onuruna ayrıntılı bir takdir töreni düzenledi. Kekulé burada teorinin yaratılışından bahsetti. Benzen molekülünün halka şeklini, kendi kuyruğunu yakalayan bir yılanın hayalini kurduktan sonra keşfettiğini söyledi (bu, Ouroboros veya Sonsuz düğüm olarak bilinen birçok eski kültürde yaygın bir semboldür). Bu vizyonun kendisine, karbon-karbon bağlarının doğasını yıllarca inceledikten sonra geldiğini söyledi. Bu, karbon atomlarının aynı anda en fazla dört başka atoma nasıl bağlanabildiği problemini çözdükten 7 yıl sonraydı. İlginçtir ki, benzenin benzer, mizahi bir tasviri 1886'da Berichte der Durstigen Chemischen Gesellschaft (Susamış Kimya Topluluğu Dergisi) adlı bir broşürde yer almıştı, Berichte der Deutschen Chemischen Gesellschaft'ın bir parodisiydi, ancak parodide Kekulé'nin anekdotundaki gibi yılanlar yerine bir daire içinde birbirini yakalayan maymunlar vardı. Bazı tarihçiler parodinin yılan anekdotunun bir alayı olduğunu, muhtemelen henüz basılı olarak ortaya çıkmamış olsa bile sözlü aktarım yoluyla zaten iyi bilindiğini öne sürmüşlerdir. Kekule'nin bu anekdotun yer aldığı 1890 tarihli konuşması İngilizceye çevrilmiştir. Eğer anekdot gerçek bir olayın anısı ise, hikayede bahsedilen koşullar bunun 1862 yılının başlarında gerçekleşmiş olması gerektiğini düşündürmektedir. ⓘ
1929 yılında, benzenin döngüsel doğası kristalograf Kathleen Lonsdale tarafından X-ışını kırınım yöntemleri kullanılarak nihayet doğrulandı. Lonsdale, altı karbon atomundan oluşan aynı çekirdeğe sahip bir benzen türevi olan hekzametilbenzenin büyük kristallerini kullanarak kırınım desenleri elde etti. Otuzdan fazla parametre hesaplayan Lonsdale, benzen halkasının düz bir altıgenden başka bir şey olamayacağını gösterdi ve moleküldeki tüm karbon-karbon bağları için doğru mesafeler sağladı. ⓘ
İsimlendirme
Alman kimyager Wilhelm Körner 1867'de di-sübstitüe benzen türevlerini ayırt etmek için orto-, meta-, para- öneklerini önermiştir; ancak bu önekleri benzen halkası üzerindeki sübstitüentlerin göreceli konumlarını ayırt etmek için kullanmamıştır. Orto-, meta-, para- öneklerini ilk kez 1869'da di-sübstitüe aromatik bir halka (yani naftalin) üzerindeki sübstitüentlerin belirli göreceli konumlarını belirtmek için kullanan Alman kimyager Karl Gräbe olmuştur. 1870 yılında Alman kimyager Viktor Meyer, Gräbe'nin isimlendirmesini ilk kez benzene uygulamıştır. ⓘ
Erken dönem uygulamalar
19. yüzyılda ve 20. yüzyılın başlarında benzen, hoş kokusu nedeniyle tıraş sonrası losyonu olarak kullanılmıştır. 1920'lerden önce benzen, özellikle metallerin yağını gidermek için endüstriyel bir çözücü olarak sıklıkla kullanılıyordu. Toksisitesi belirginleştikçe, benzenin yerini diğer çözücüler, özellikle de benzer fiziksel özelliklere sahip ancak kanserojen olmayan toluen (metilbenzen) almıştır. ⓘ
1903 yılında Ludwig Roselius, kahveyi kafeinsizleştirmek için benzen kullanımını yaygınlaştırdı. Bu keşif Sanka'nın üretilmesine yol açtı. Bu işlem daha sonra durdurulmuştur. Benzen tarihsel olarak Sıvı İngiliz Anahtarı, çeşitli boya sıyırıcılar, kauçuk çimentolar, leke çıkarıcılar ve diğer ürünler gibi birçok tüketici ürününde önemli bir bileşen olarak kullanılmıştır. Bu benzen içeren formülasyonların bazılarının üretimi yaklaşık 1950'de sona ermiştir, ancak Liquid Wrench 1970'lerin sonlarına kadar önemli miktarda benzen içermeye devam etmiştir. ⓘ
Oluşum
Petrol ve kömürde eser miktarda benzen bulunur. Birçok maddenin eksik yanmasının bir yan ürünüdür. Ticari kullanım için, İkinci Dünya Savaşı'na kadar, benzenin çoğu çelik endüstrisi için kok üretiminin (veya "kok fırını hafif yağı") bir yan ürünü olarak elde edildi. Ancak 1950'lerde, özellikle büyüyen polimer endüstrisinden gelen artan benzen talebi, petrolden benzen üretimini zorunlu kılmıştır. Günümüzde benzenin çoğu petrokimya endüstrisinden elde edilmekte, sadece küçük bir kısmı kömürden üretilmektedir. Mars'ta benzen molekülleri tespit edilmiştir. ⓘ
Yapı

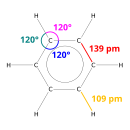
X-ışını kırınımı, benzendeki altı karbon-karbon bağının hepsinin 140 pikometre (pm) ile aynı uzunlukta olduğunu göstermektedir. C-C bağ uzunlukları bir çift bağdan (135 pm) daha büyük ancak bir tek bağdan (147 pm) daha kısadır. Bu ara mesafe elektron delokalizasyonundan kaynaklanır: C=C bağı için elektronlar altı karbon atomunun her biri arasında eşit olarak dağıtılır. Benzen 6 hidrojen atomuna sahiptir, bu da 14 hidrojen atomuna sahip olan ana alkan hekzandan daha azdır. Benzen ve siklohekzan benzer bir yapıya sahiptir, sadece delokalize elektron halkası ve karbon başına bir hidrojen kaybı onu siklohekzandan ayırır. Molekül düzlemseldir. Moleküler orbital tanımı, altı karbon atomunun tümünü kapsayan üç delokalize π orbitalinin oluşumunu içerirken, değerlik bağı tanımı rezonans yapılarının süperpozisyonunu içerir. Bu kararlılığın aromatiklik olarak bilinen kendine özgü moleküler ve kimyasal özelliklere katkıda bulunması muhtemeldir. Bağın doğasını doğru bir şekilde yansıtmak için benzen genellikle altıgen karbon atomu dizilimi içinde bir daire ile tasvir edilir. ⓘ
Benzen türevleri organik moleküllerin bir bileşeni olarak yeterince sık ortaya çıkar ve Unicode Konsorsiyumu bunu üç çift bağ ile temsil etmek için Çeşitli Teknik blokta U+232C (⌬) kodlu bir sembol tahsis etmiştir ve delokalize bir versiyon için U+23E3 (⏣). ⓘ
Benzen türevleri
Birçok önemli kimyasal bileşik, bir veya daha fazla hidrojen atomunun başka bir fonksiyonel grupla değiştirilmesiyle benzenden türetilir. Basit benzen türevlerine örnek olarak sırasıyla PhOH, PhMe ve PhNH2 olarak kısaltılan fenol, toluen ve anilin verilebilir. Benzen halkalarının bağlanması bifenil, C6H5-C6H5 verir. Daha fazla hidrojen kaybı naftalin, antrasen, fenantren ve piren gibi "kaynaşmış" aromatik hidrokarbonları verir. Füzyon sürecinin sınırı, karbonun hidrojen içermeyen allotropu olan grafittir. ⓘ
Heterosikllerde, benzen halkasındaki karbon atomları diğer elementlerle değiştirilir. En önemli varyasyonlar nitrojen içerir. Bir CH'nin N ile değiştirilmesi piridin bileşiğini verir, C5H5N. Benzen ve piridin yapısal olarak ilişkili olmalarına rağmen, benzen piridine dönüştürülemez. İkinci bir CH bağının N ile değiştirilmesi, ikinci N'nin konumuna bağlı olarak, piridazin, pirimidin veya pirazin verir. ⓘ
Üretim
Endüstriyel benzen üretimine dört kimyasal süreç katkıda bulunur: katalitik reformasyon, toluen hidrodealkilasyon, toluen orantısızlaştırma ve buhar krakingi. Benzen için ATSDR Toksikolojik Profiline göre, 1978 ve 1981 yılları arasında, katalitik reformatlar toplam ABD benzen üretiminin yaklaşık %44-50'sini oluşturmuştur. ⓘ
Katalitik reformasyon
Katalitik reformlamada, kaynama noktaları 60 ila 200 °C arasında olan bir hidrokarbon karışımı hidrojen gazı ile karıştırılır ve ardından 500-525 °C'de ve 8-50 atm arasında değişen basınçlarda iki işlevli bir platin klorür veya renyum klorür katalizörüne maruz bırakılır. Bu koşullar altında alifatik hidrokarbonlar halka oluşturur ve hidrojen kaybederek aromatik hidrokarbonlara dönüşür. Reaksiyonun aromatik ürünleri daha sonra dietilen glikol veya sülfolan dahil olmak üzere bir dizi çözücüden herhangi biriyle ekstraksiyon yoluyla reaksiyon karışımından (veya reformattan) ayrılır ve benzen daha sonra damıtma yoluyla diğer aromatiklerden ayrılır. Aromatiklerin reformattan ekstraksiyon aşaması, aromatik olmayan bileşenleri en düşük olan aromatikleri üretmek için tasarlanmıştır. Genellikle BTX (benzen, toluen ve ksilen izomerleri) olarak adlandırılan aromatiklerin geri kazanımı, bu tür ekstraksiyon ve damıtma adımlarını içerir. ⓘ
Bu katalitik reformasyona benzer şekilde, UOP ve BP LPG'den (esas olarak propan ve bütan) aromatiklere bir yöntemi ticarileştirmiştir. ⓘ
Toluen hidrodealkilasyonu
Toluen hidrodealkilasyonu tolueni benzene dönüştürür. Bu hidrojen yoğun proseste, toluen hidrojenle karıştırılır, ardından 500-650 °C ve 20-60 atm basınçta bir krom, molibden veya platin oksit katalizörü üzerinden geçirilir. Bazen katalizör yerine daha yüksek sıcaklıklar kullanılır (benzer reaksiyon koşullarında). Bu koşullar altında toluen, benzen ve metana dealkilasyona uğrar:
- Ayrıştırılamadı (sözdizim hatası): {\displaystyle \ce{C6H5CH3 + H2 -> C6H6 + CH4 <span title="Kaynak: İngilizce Vikipedi, Bölüm "Toluene hydrodealkylation"" class="plainlinks">[https://en.wikipedia.org/wiki/Benzene#Toluene_hydrodealkylation <span style="color:#dddddd">ⓘ</span>]</span>}}
Bu tersinmez reaksiyona, dengede olan bir yan reaksiyon eşlik eder. daha yüksek sıcaklıkta bifenil (diğer adıyla difenil):
- 2 C
6H
6 ⇌ H
2 + C
6H
5-C
6H
5 ⓘ
Hammadde akışı çok fazla aromatik olmayan bileşen (parafinler veya naftenler) içeriyorsa, bunlar muhtemelen metan gibi daha düşük hidrokarbonlara ayrışır ve bu da hidrojen tüketimini artırır. ⓘ
Tipik bir reaksiyon verimi %95'i aşar. Bazen toluen yerine benzer verimle ksilenler ve daha ağır aromatikler kullanılır. ⓘ
Buna genellikle geleneksel BTX (benzen-toluen-ksilen) ekstraksiyon proseslerine kıyasla benzen üretmek için "amaca yönelik" metodoloji denir. ⓘ
Toluen orantısızlaştırma
Toluen orantısızlaştırma (TDP), toluenin benzen ve ksilene dönüştürülmesidir. ⓘ
Para-ksilen (p-ksilen) talebinin diğer ksilen izomerlerine olan talebi önemli ölçüde aştığı göz önüne alındığında, TDP prosesinin Seçici TDP (STDP) adı verilen bir iyileştirmesi kullanılabilir. Bu proseste, TDP ünitesinden çıkan ksilen akışı yaklaşık %90 oranında p-ksilendir. Bazı sistemlerde benzen-ksilen oranı bile ksilen lehine değiştirilir. ⓘ
Buhar krakingi
Buhar krakingi, alifatik hidrokarbonlardan etilen ve diğer alkenlerin üretilmesi için kullanılan bir işlemdir. Olefinleri üretmek için kullanılan hammaddeye bağlı olarak, buhar krakingi piroliz benzini adı verilen benzen bakımından zengin bir sıvı yan ürün üretebilir. Piroliz benzini, benzin katkı maddesi olarak diğer hidrokarbonlarla karıştırılabilir veya BTX aromatiklerini (benzen, toluen ve ksilenler) geri kazanmak için bir ekstraksiyon işleminden geçirilebilir. ⓘ
Diğer yöntemler
Ticari önemi olmamasına rağmen, benzene giden birçok başka yol mevcuttur. Fenol ve halobenzenler metallerle indirgenebilir. Benzoik asit ve tuzları benzene dekarboksilasyona uğrar. Anilinden türetilen diazonyum bileşiğinin hipofosfor asidi ile reaksiyonu benzen verir. Asetilenin alkin trimerizasyonu benzen verir. ⓘ
Kullanım Alanları
Benzen, başta etilbenzen (ve diğer alkilbenzenler), kümen, siklohekzan ve nitrobenzen olmak üzere diğer kimyasalların yapımında ara madde olarak kullanılır. 1988 yılında Amerikan Kimya Derneği'nin listelerindeki tüm kimyasalların üçte ikisinin en az bir benzen halkası içerdiği bildirilmiştir. Tüm benzen üretiminin yarısından fazlası, polimerlerin ve polistiren gibi plastiklerin yapımında kullanılan stirenin öncüsü olan etilbenzene dönüştürülmektedir. Benzen üretiminin yaklaşık %20'si, reçine ve yapıştırıcılar için fenol ve aseton üretmek için gerekli olan kümen üretiminde kullanılır. Sikloheksan, dünya benzen üretiminin yaklaşık %10'unu tüketir; öncelikle tekstil ve mühendislik plastiklerine işlenen naylon liflerin üretiminde kullanılır. Daha az miktarda benzen ise bazı kauçuk türlerinin, yağlayıcıların, boyaların, deterjanların, ilaçların, patlayıcıların ve böcek ilaçlarının yapımında kullanılmaktadır. 2013 yılında benzenin en büyük tüketici ülkesi Çin olurken, onu ABD takip etmiştir. Benzen üretimi şu anda Orta Doğu ve Afrika'da artarken, Batı Avrupa ve Kuzey Amerika'daki üretim kapasiteleri durgunlaşmaktadır. ⓘ
Toluen artık sıklıkla benzenin yerine, örneğin yakıt katkısı olarak kullanılmaktadır. İkisinin çözücü özellikleri benzerdir, ancak toluen daha az toksiktir ve daha geniş bir sıvı aralığına sahiptir. Toluen ayrıca işlenerek benzene dönüştürülür. ⓘ
Hata: 3 satırının sonunda geçerli bir bağlantı bulunamadı.
Benzin bileşeni
Benzin (petrol) katkı maddesi olarak benzen oktan değerini artırır ve vuruntuyu azaltır. Sonuç olarak, tetraetil kurşunun en yaygın kullanılan vuruntu önleyici katkı maddesi olarak yerini aldığı 1950'lerden önce benzin genellikle yüzde birkaç oranında benzen içermekteydi. Kurşunlu benzinin küresel olarak kullanımdan kaldırılmasıyla birlikte, benzen bazı ülkelerde benzin katkı maddesi olarak geri dönüş yapmıştır. Amerika Birleşik Devletleri'nde, olumsuz sağlık etkileri ve benzenin yeraltı sularına karışması olasılığı konusundaki endişeler, benzinin benzen içeriğinin sıkı bir şekilde düzenlenmesine yol açmıştır ve sınırlar genellikle %1 civarındadır. Avrupa benzin spesifikasyonları artık benzen içeriği için aynı %1 sınırını içermektedir. Amerika Birleşik Devletleri Çevre Koruma Ajansı 2011 yılında benzindeki benzen içeriğini %0,62'ye düşüren yeni düzenlemeler getirmiştir. Birçok Avrupa dilinde petrol veya benzin kelimesi "benzene" kelimesinin tam karşılığıdır. ⓘ
Tepkiler
Benzenin en yaygın reaksiyonları, bir protonun diğer gruplarla yer değiştirmesini içerir. Elektrofilik aromatik sübstitüsyon benzenin türevlendirilmesinde kullanılan genel bir yöntemdir. Benzen, sübstitüe türevler vermek üzere asilyum iyonları ve alkil karbokatyonlar tarafından sübstitüsyona uğrayacak kadar nükleofiliktir.
 Benzenin elektrofilik aromatik sübstitüsyonu ⓘ
Benzenin elektrofilik aromatik sübstitüsyonu ⓘ
Bu reaksiyonun en yaygın olarak uygulanan örneği benzenin etilasyonudur.
1999 yılında yaklaşık 24.700.000 ton üretilmiştir. Oldukça öğretici ancak çok daha az endüstriyel öneme sahip olan, güçlü bir Lewis asit katalizörü varlığında bir alkil halojenür kullanılarak benzenin (ve diğer birçok aromatik halkanın) Friedel-Crafts alkilasyonudur. Benzer şekilde, Friedel-Crafts asilasyonu elektrofilik aromatik sübstitüsyonun ilgili bir örneğidir. Reaksiyon, alüminyum klorür veya Demir (III) klorür gibi güçlü bir Lewis asit katalizörü kullanılarak benzenin (veya diğer birçok aromatik halkanın) bir açil klorür ile açilasyonunu içerir. ⓘ

Sülfonasyon, klorlama, nitrasyon
Elektrofilik aromatik sübstitüsyon kullanılarak benzen iskeletine birçok fonksiyonel grup eklenir. Benzenin sülfonasyonu, sülfürik asit ile sülfür trioksit karışımı olan oleum kullanımını içerir. Sülfonlanmış benzen türevleri faydalı deterjanlardır. Nitrasyonda benzen, sülfürik ve nitrik asitlerin birleştirilmesiyle üretilen güçlü bir elektrofil olan nitronyum iyonları (NO2+) ile reaksiyona girer. Nitrobenzen anilinin öncüsüdür. Klorlama, alüminyum tri-klorür gibi bir Lewis asit katalizörü varlığında klorobenzen vermek için klor ile gerçekleştirilir. ⓘ
Hidrojenasyon
Hidrojenasyon yoluyla benzen ve türevleri siklohekzan ve türevlerine dönüşür. Bu reaksiyon, ince bölünmüş nikel gibi heterojen katalizörlerin varlığında yüksek hidrojen basınçlarının kullanılmasıyla elde edilir. Alkenler oda sıcaklığına yakın sıcaklıklarda hidrojenlenebilirken, benzen ve ilgili bileşikler daha isteksiz substratlardır ve 100 °C'nin üzerinde sıcaklıklar gerektirirler. Bu reaksiyon endüstriyel olarak büyük ölçekte uygulanmaktadır. Katalizör yokluğunda benzen hidrojene karşı geçirimsizdir. Hidrojenasyon, sikloheksen veya sikloheksadienler vermek için durdurulamaz çünkü bunlar üstün substratlardır. Ancak katalitik olmayan bir süreç olan huş indirgemesi benzeni seçici olarak diene hidrojenlendirir. ⓘ
Metal kompleksleri
Benzen, düşük değerli metallerin organometalik kimyasında mükemmel bir liganddır. Önemli örnekler arasında sırasıyla sandviç ve yarım sandviç kompleksleri, Cr(C6H6)2 ve [RuCl2(C6H6)]2 yer alır. ⓘ
Sağlık etkileri

Benzen, kanser ve diğer hastalıkların riskini artıran bir kanserojen olarak sınıflandırılır ve aynı zamanda kemik iliği yetmezliğinin bilinen bir nedenidir. Önemli miktarda epidemiyolojik, klinik ve laboratuvar verisi benzeni aplastik anemi, akut lösemi, kemik iliği anormallikleri ve kardiyovasküler hastalıklarla ilişkilendirmektedir. Benzenin ilişkili olduğu spesifik hematolojik maligniteler şunlardır: akut myeloid lösemi (AML), aplastik anemi, myelodisplastik sendrom (MDS), akut lenfoblastik lösemi (ALL) ve kronik myeloid lösemi (CML). ⓘ
Amerikan Petrol Enstitüsü (API) 1948 yılında "benzen için kesinlikle güvenli tek konsantrasyonun sıfır olduğu genel olarak kabul edilmektedir" demiştir. Güvenli bir maruz kalma seviyesi yoktur; çok küçük miktarlar bile zarara neden olabilir. ABD Sağlık ve İnsan Hizmetleri Bakanlığı (DHHS) benzeni insan kanserojeni olarak sınıflandırmaktadır. Havadaki aşırı benzen seviyelerine uzun süre maruz kalmak, kan oluşturan organların potansiyel olarak ölümcül bir kanseri olan lösemiye neden olur. Özellikle akut miyeloid lösemi veya akut lenfositik olmayan lösemi (AML & ANLL) benzenden kaynaklanmaktadır. IARC benzeni "insanlar için kanserojen olduğu bilinen" (Grup 1) olarak derecelendirmiştir. ⓘ
Benzen, her yerde kullanılan benzin ve hidrokarbon yakıtlarda her yerde bulunduğundan, insanların benzene maruz kalması küresel bir sağlık sorunudur. Benzen karaciğer, böbrek, akciğer, kalp ve beyni hedef alır ve DNA iplikçik kırılmalarına ve kromozomal hasara neden olabilir. Benzen, insanlar da dahil olmak üzere hayvanlarda kansere neden olmaktadır. Benzenin, çeşitli yollarla maruz kalan çok sayıda laboratuvar hayvanı türünün her iki cinsiyetinde de kansere neden olduğu gösterilmiştir. ⓘ
Benzene maruz kalma
Toksik Maddeler ve Hastalık Kayıt Ajansı'na (ATSDR) (2007) göre, benzen hem sentetik olarak üretilen hem de volkanik patlamalar, vahşi yangınlar, fenol gibi kimyasalların sentezi, sentetik elyaf üretimi ve kauçuk, yağlayıcılar, böcek ilaçları, ilaçlar ve boyaların imalatı gibi süreçlerden doğal olarak oluşan bir kimyasaldır. Benzene maruz kalmanın başlıca kaynakları tütün dumanı, otomobil servis istasyonları, motorlu taşıtlardan çıkan egzoz ve endüstriyel emisyonlardır; ancak benzenin yutulması ve dermal emilimi kontamine suyla temas yoluyla da gerçekleşebilir. Benzen hepatik olarak metabolize edilir ve idrarla atılır. Hava ve sudaki benzen seviyelerinin ölçümü, aktif kömür tüpleri aracılığıyla toplanarak gerçekleştirilir ve daha sonra bir gaz kromatografı ile analiz edilir. İnsanlarda benzen ölçümü idrar, kan ve nefes testleri ile gerçekleştirilebilir; ancak benzen insan vücudunda hızla metabolize olduğu için bunların hepsinin sınırlamaları vardır. ⓘ
Benzene maruz kalmak aşamalı olarak aplastik anemi, lösemi ve multipl miyeloma yol açabilir. ⓘ
OSHA işyerindeki benzen seviyelerini düzenler. Çalışma odası havasında 8 saatlik bir iş günü, 40 saatlik bir iş haftası boyunca izin verilen maksimum benzen miktarı 1 ppm'dir. Benzen kansere neden olabileceğinden, NIOSH tüm çalışanların önerilen (8 saatlik) maruz kalma sınırı olan 0,1 ppm'i aşan seviyelerde benzene maruz kalma olasılıkları olduğunda özel solunum ekipmanı kullanmalarını önermektedir. ⓘ
Benzen maruziyet limitleri
Amerika Birleşik Devletleri Çevre Koruma Ajansı, ABD Ulusal Birincil İçme Suyu Yönetmeliği ile içme suyunda benzen için maksimum kirletici seviyesini (MCL) 0,005 mg/L (5 ppb) olarak belirlemiştir. Bu düzenleme benzen lösemogenezinin önlenmesine dayanmaktadır. Olumsuz etkilerin önlenmesi için yeterli bir güvenlik marjı sağlayacak, uygulanabilir olmayan bir sağlık hedefi olan maksimum kirletici seviyesi hedefi (MCLG), içme suyunda sıfır benzen konsantrasyonudur. EPA, 10 pound (4,5 kg) veya daha fazla benzenin çevreye dökülmesi veya kazara salınmasının rapor edilmesini şart koşmaktadır. ⓘ
ABD Mesleki Güvenlik ve Sağlık İdaresi (OSHA), 8 saatlik bir iş günü, 40 saatlik bir iş haftası boyunca işyerinde izin verilen maruz kalma sınırını milyon parça hava başına 1 parça benzen (1 ppm) olarak belirlemiştir. Havadaki benzen için kısa süreli maruziyet sınırı 15 dakika için 5 ppm'dir. Bu yasal sınırlar, benzene maruz kalan işçiler için sağlık riskine dair ikna edici kanıtlar ortaya koyan çalışmalara dayanmaktadır. Bir çalışma hayatı boyunca 1 ppm'e maruz kalmaktan kaynaklanan risk, maruz kalan 1.000 çalışan başına 5 aşırı lösemi ölümü olarak tahmin edilmiştir. (Bu tahmin, benzenin kanserojen etkileri için bir eşik olmadığını varsaymaktadır.) OSHA ayrıca işyerinde daha da düşük maruziyetleri teşvik etmek için 0,5 ppm'lik bir eylem seviyesi belirlemiştir. ⓘ
ABD Ulusal Mesleki Güvenlik ve Sağlık Enstitüsü (NIOSH), benzen için Yaşam ve Sağlık İçin Hemen Tehlikeli (IDLH) konsantrasyonunu 500 ppm olarak revize etmiştir. NIOSH Solunum Cihazı Seçim Mantığı'nda belirtildiği gibi, IDLH durumu için mevcut NIOSH tanımı, maruziyetin ölüme veya ani veya gecikmeli kalıcı olumsuz sağlık etkilerine neden olması veya böyle bir ortamdan kaçmayı engellemesi muhtemel olduğunda havadaki kirleticilere maruz kalma tehdidi oluşturan bir durumdur [NIOSH 2004]. IDLH değerinin belirlenmesinin amacı (1) solunum koruma ekipmanının arızalanması durumunda çalışanın belirli bir kirlenmiş ortamdan kaçabilmesini sağlamaktır ve (2) yalnızca maksimum çalışan koruması sağlayan son derece güvenilir bir solunum cihazına izin verilen maksimum seviye olarak kabul edilir [NIOSH 2004]. Eylül 1995'te NIOSH, kanserojenler de dahil olmak üzere maddeler için önerilen maruz kalma sınırlarının (REL'ler) geliştirilmesi için yeni bir politika yayınlamıştır. Benzen kansere neden olabileceğinden, NIOSH tüm çalışanların REL (10 saatlik) 0,1 ppm'i aşan seviyelerde benzene maruz kalma olasılıkları olduğunda özel solunum ekipmanı kullanmalarını önermektedir. NIOSH kısa süreli maruz kalma sınırı (STEL - 15 dakika) 1 ppm'dir. ⓘ
Amerikan Resmi Endüstriyel Hijyenistler Konferansı (ACGIH) benzen için 0,5 ppm TWA ve 2,5 ppm STEL Eşik Sınır Değerlerini (TLV'ler) kabul etmiştir. ⓘ
Toksikoloji
Biyolojik maruziyet belirteçleri
Benzen maruziyetini çeşitli testler belirleyebilir. Benzenin kendisi nefes, kan veya idrarda ölçülebilir, ancak bu tür testler, kimyasalın soluma veya biyotransformasyon yoluyla nispeten hızlı bir şekilde uzaklaştırılması nedeniyle genellikle maruziyet sonrası ilk 24 saatle sınırlıdır. Gelişmiş ülkelerdeki çoğu insanın kanında ölçülebilir düzeyde benzen ve diğer aromatik petrol hidrokarbonları bulunmaktadır. Benzen vücutta enzimatik olarak mukonik asit, fenilmerkapturik asit, fenol, katekol, hidrokinon ve 1,2,4-trihidroksibenzen gibi bir dizi oksidasyon ürününe dönüştürülür. Bu metabolitlerin çoğu, maruziyetin kapsamı ve süresiyle orantılı olarak idrarda biriktiğinden ve maruziyet sona erdikten sonra birkaç gün boyunca hala mevcut olabileceğinden, insan maruziyetinin biyolojik belirteçleri olarak bir değere sahiptir. Mesleki maruziyet için mevcut ACGIH biyolojik maruziyet sınırları, vardiya sonu idrar örneğinde mukonik asit için 500 μg/g kreatinin ve fenilmerkapturik asit için 25 μg/g kreatinindir. ⓘ
Biyotransformasyonlar
Metabolizma için yaygın bir substrat olmasa bile benzen hem bakteriler hem de ökaryotlar tarafından oksitlenebilir. Bakterilerde, dioksijenaz enzimi halkaya bir oksijen ekleyebilir ve kararsız ürün hemen (NADH tarafından) aromatikliği kırarak iki çift bağa sahip siklik bir diole indirgenir. Daha sonra, diol NADH tarafından yeniden katekole indirgenir. Katekol daha sonra asetil CoA ve süksinil CoA'ya metabolize edilir ve organizmalar tarafından esas olarak enerji üretimi için Sitrik Asit Döngüsünde kullanılır. ⓘ
Benzen metabolizması için yol karmaşıktır ve karaciğerde başlar. Çeşitli enzimler söz konusudur. Bunlar arasında sitokrom P450 2E1 (CYP2E1), kinin oksidoredüktaz (NQ01 veya DT-diaforaz veya NAD(P)H dehidrojenaz (kinon 1)), GSH ve miyeloperoksidaz (MPO) bulunur. CYP2E1, benzenin oksepine (benzen oksit), fenolün hidrokinona ve hidrokinonun hem benzenetriol hem de katekole dönüştürülmesi gibi birçok adımda rol oynar. Hidrokinon, benzenetriol ve katekol polifenollere dönüştürülür. Kemik iliğinde MPO bu polifenolleri benzokinonlara dönüştürür. Bu ara ürünler ve metabolitler, topoizomeraz II'nin inhibisyonu (kromozom yapısını korur), mikrotübüllerin bozulması (hücresel yapı ve organizasyonu korur), nokta mutasyonlarına yol açabilen oksijensiz radikallerin (kararsız türler) oluşumu, oksidatif stresin artması, DNA iplikçik kırılmalarının indüklenmesi ve DNA metilasyonunun değiştirilmesi (gen ifadesini etkileyebilir) gibi çoklu mekanizmalarla genotoksisiteye neden olur. NQ01 ve GSH metabolizmayı toksisiteden uzaklaştırır. NQ01 benzokinonu polifenollere doğru metabolize eder (MPO'nun etkisine karşı koyar). GSH fenilmerkapturik asit oluşumu ile ilgilidir. ⓘ
Bu enzimlerdeki genetik polimorfizmler işlev kaybına veya işlev kazanımına neden olabilir. Örneğin, CYP2E1'deki mutasyonlar aktiviteyi artırır ve toksik metabolitlerin oluşumunda artışa neden olur. NQ01 mutasyonları fonksiyon kaybına neden olur ve detoksifikasyonun azalmasına yol açabilir. Miyeloperoksidaz mutasyonları işlev kaybına neden olur ve toksik metabolitlerin oluşumunun azalmasına yol açabilir. GSH mutasyonları veya delesyonları fonksiyon kaybına neden olur ve detoksifikasyonun azalmasına yol açar. Bu genler, benzen toksisitesine duyarlılık için genetik taramada hedef olabilir. ⓘ
Moleküler toksikoloji
Benzenin toksikolojik değerlendirme paradigması, temel biyolojik mekanizmaların daha iyi anlaşılmasına olanak tanıdığı için moleküler toksikoloji alanına doğru kaymaktadır. Glutatyon, benzen kaynaklı DNA kırılmalarına karşı koruma sağlayarak önemli bir rol oynuyor gibi görünmektedir ve maruziyet ve etki için yeni bir biyobelirteç olarak tanımlanmaktadır. Benzen, periferik kan lökositlerinde ve kemik iliğinde kromozomal sapmalara neden olarak kronik maruziyetin neden olduğu daha yüksek lösemi ve multipl miyelom insidansını açıklamaktadır. Bu sapmalar, hematotoksisite belirteçleri olarak hematolojik testlerle birlikte benzenin etkilerini değerlendirmek için DNA probları ile floresan in situ hibridizasyon (FISH) kullanılarak izlenebilir. Benzen metabolizması polimorfik genler tarafından kodlanan enzimleri içerir. Çalışmalar, bu lokuslardaki genotipin benzen maruziyetinin toksik etkilerine karşı duyarlılığı etkileyebileceğini göstermiştir. NAD(P)H:kinon oksidoredüktaz 1 (NQO1), mikrozomal epoksit hidrolaz (EPHX) ve glutatyon S-transferaz T1 (GSTT1) delesyonu varyantı taşıyan bireylerde DNA tek sarmallı kırılma sıklığı daha yüksektir. ⓘ
Biyolojik oksidasyon ve karsinojenik aktivite
Benzenin kanserojen etkilerini anlamanın bir yolu da biyolojik oksidasyon ürünlerini incelemektir. Örneğin saf benzen, vücutta oksitlenerek bir epoksit, benzen oksit üretir; bu oksit kolayca atılmaz ve zararlı mutasyonlar üretmek için DNA ile etkileşime girebilir. ⓘ
Maruz kalma yolları
Soluma
Dış ortam havası, otomobil servis istasyonlarından, odun dumanından, tütün dumanından, benzin transferinden, motorlu taşıtların egzozundan ve endüstriyel emisyonlardan kaynaklanan düşük seviyelerde benzen içerebilir. Tüm ülke çapında (Amerika Birleşik Devletleri) benzene maruz kalmanın yaklaşık %50'si tütün içmekten veya tütün dumanına maruz kalmaktan kaynaklanmaktadır. Günde 32 sigara içen bir kişi yaklaşık 1,8 miligram (mg) benzen almış olur. Bu miktar, sigara içmeyenlerin günlük ortalama benzen alımının yaklaşık 10 katıdır. ⓘ
Solunan benzen öncelikle nefes verme yoluyla değişmeden dışarı atılır. Bir insan çalışmasında, 47 ila 110 ppm'e iki ila üç saatlik bir maruziyetten sonra tutulan benzenin %16,4 ila 41,6'sı beş ila yedi saat içinde akciğerlerden atılmış ve kalan benzenin sadece %0,07 ila 0,2'si idrarla değişmeden atılmıştır. 1 ila 5 saat süreyle 63 ila 405 mg/m3 benzene maruz kalındıktan sonra, 23 ila 50 saatlik bir süre içinde benzenin %51 ila 87'si idrarla fenol olarak atılmıştır. Başka bir insan çalışmasında, öncelikle karaciğerde metabolize olan, deri yoluyla uygulanan benzenin %30'u idrarla fenol olarak atılmıştır. ⓘ
Alkolsüz içeceklerden maruz kalma
Belirli koşullar altında ve diğer kimyasalların varlığında benzoik asit (bir koruyucu) ve askorbik asit (C Vitamini) etkileşime girerek benzen üretebilir. Mart 2006'da İngiltere'deki resmi Gıda Standartları Ajansı 150 meşrubat markası üzerinde bir araştırma yapmıştır. Dört tanesinin Dünya Sağlık Örgütü limitlerinin üzerinde benzen içerdiği tespit edilmiştir. Etkilenen partiler satıştan kaldırılmıştır. Benzer sorunlar Amerika Birleşik Devletleri'nde FDA tarafından da rapor edilmiştir. ⓘ
Su kaynaklarının kirlenmesi
2005 yılında, Çin'in yaklaşık dokuz milyon nüfuslu Harbin şehrinin su kaynağı, büyük bir benzen maruziyeti nedeniyle kesilmiştir. Benzen, 13 Kasım 2005 tarihinde Jilin kentindeki bir Çin Ulusal Petrol Şirketi (CNPC) fabrikasında meydana gelen patlamanın ardından kente içme suyu sağlayan Songhua Nehri'ne sızmıştır. ⓘ
Plastik su boruları yüksek ısıya maruz kaldığında, su benzen ile kirlenebilir. ⓘ
Soykırım
Naziler öldürmek için birçok yöntemden biri olarak enjeksiyon yoluyla uygulanan benzen kullanmıştır. ⓘ
Elde edilişi
Benzenin sübstitüsyon (yer değiştirme) tepkimeleri oldukça önemlidir. Çünkü, aromatik bileşiklerin pek çoğu bu tepkimelerle oluşturulur. II. Dünya Savaşı'ndan önce benzenin önemli kaynağı maden kömüründen elde edilen katran idi. İkinci Dünya Savaşı sırasında benzen ve bununla ilgili aromatik hidrokarbonlara (toluen, ksilen vb.) duyulan büyük ihtiyaç sebebiyle başka kaynaklar aranmaya başlandı. Bugün Amerika'da üretilen benzenin % 75'i petrolden olup, toluenin (C6H5-CH3) veya toluen içeren petrolün dealkilizasyonu işlemi ile yapılmaktadır. Bu işlem hidrojen kullanmayı, yüksek sıcaklığı, basıncı ve bir de katalizörü gerektirmektedir. İkinci bir metot naftence zengin petrolün yüksek sıcaklık ve basınçta dehidrojenlenmesidir. Benzen, fenol'ün indirgenmesiyle ve asetilenin trimerizasyonundan elde edilir. ⓘ