Antibiyotik
| Antibiyotik ⓘ | |
|---|---|
| İlaç sınıfı | |
 Staphylococcus aureus'un antibiyotiklere karşı duyarlılığının Kirby-Bauer disk difüzyon yöntemiyle test edilmesi - antibiyotikler antibiyotik içeren disklerden yayılır ve S. aureus'un büyümesini engelleyerek bir inhibisyon bölgesi oluşturur. |
Antibiyotik, bakterilere karşı aktif olan bir tür antimikrobiyal maddedir. Bakteriyel enfeksiyonlarla savaşmak için en önemli antibakteriyel ajan türüdür ve antibiyotik ilaçlar bu tür enfeksiyonların tedavisinde ve önlenmesinde yaygın olarak kullanılmaktadır. Bakterileri öldürebilir ya da büyümelerini engelleyebilirler. Sınırlı sayıda antibiyotik de antiprotozoal aktiviteye sahiptir. Antibiyotikler soğuk algınlığı veya grip gibi virüslere karşı etkili değildir; virüsleri inhibe eden ilaçlar antibiyotik yerine antiviral ilaçlar veya antiviraller olarak adlandırılır. ⓘ
Bazen antibiyotik terimi - Yunanca ἀντι anti, "karşı" ve βίος bios, "yaşam" köklerinden gelen, kelimenin tam anlamıyla "yaşama karşı" - mikroplara karşı kullanılan herhangi bir maddeyi ifade etmek için geniş anlamda kullanılır, ancak olağan tıbbi kullanımda, antibiyotikler (penisilin gibi) doğal olarak üretilenlerdir (bir mikroorganizmanın diğeriyle savaşması), oysa antibiyotik olmayan antibakteriyeller (sülfonamidler ve antiseptikler gibi) tamamen sentetiktir. Bununla birlikte, her iki sınıf da mikroorganizmaları öldürmek veya büyümelerini önlemek gibi aynı amaca sahiptir ve her ikisi de antimikrobiyal kemoterapiye dahildir. "Antibakteriyeller" antiseptik ilaçlar, antibakteriyel sabunlar ve kimyasal dezenfektanları içerirken, antibiyotikler daha spesifik olarak tıpta ve bazen de hayvan yemlerinde kullanılan önemli bir antibakteriyel sınıfıdır. ⓘ
Antibiyotikler çok eski zamanlardan beri kullanılmaktadır. Birçok uygarlık küflü ekmeği topikal olarak uygulamıştır; eski Mısır, Nubia, Çin, Sırbistan, Yunanistan ve Roma'da yararlı etkilerine dair birçok referans bulunmaktadır. Enfeksiyonları tedavi etmek için küf kullanımını doğrudan belgeleyen ilk kişi John Parkinson (1567-1650) olmuştur. Antibiyotikler 20. yüzyılda tıpta devrim yarattı. Alexander Fleming (1881-1955) 1928 yılında günümüzün modern penisilini keşfetti ve yaygın kullanımı savaş zamanında önemli ölçüde faydalı oldu. Ancak antibiyotiklerin etkinliği ve kolay erişimi, aşırı kullanımlarına ve bazı bakterilerin bunlara karşı direnç geliştirmesine de yol açmıştır. Dünya Sağlık Örgütü antimikrobiyal direnci "artık geleceğe yönelik bir öngörü olmaktan çıkmış, şu anda dünyanın her bölgesinde yaşanan ve herhangi bir ülkede, herhangi bir yaştaki herkesi etkileme potansiyeline sahip ciddi bir tehdit" olarak sınıflandırmıştır. Antimikrobiyal dirence bağlı küresel ölümlerin sayısı 2019 yılında 1,27 milyona ulaşmıştır. ⓘ
Etimoloji
"Hayata karşı" anlamına gelen 'antibiyozis' terimi, Fransız bakteriyolog Jean Paul Vuillemin tarafından bu ilk antibakteriyel ilaçların sergilediği olgunun tanımlayıcı bir adı olarak ortaya atılmıştır. Antibiyoz ilk olarak 1877 yılında Louis Pasteur ve Robert Koch'un havadaki bir basilin Bacillus anthracis'in büyümesini engelleyebildiğini gözlemlemesiyle bakterilerde tanımlanmıştır. Bu ilaçlar daha sonra 1947 yılında Amerikalı bir mikrobiyolog olan Selman Waksman tarafından antibiyotik olarak yeniden adlandırılmıştır. ⓘ
Antibiyotik terimi ilk olarak 1942 yılında Selman Waksman ve çalışma arkadaşları tarafından dergi makalelerinde, bir mikroorganizma tarafından üretilen ve yüksek seyreltmede diğer mikroorganizmaların büyümesine karşı antagonistik olan herhangi bir maddeyi tanımlamak için kullanılmıştır. Bu tanım, bakterileri öldüren ancak mikroorganizmalar tarafından üretilmeyen maddeleri (mide suları ve hidrojen peroksit gibi) hariç tutmuştur. Ayrıca sülfonamidler gibi sentetik antibakteriyel bileşikleri de kapsam dışı bırakmıştır. Mevcut kullanımda "antibiyotik" terimi, bir mikroorganizma tarafından üretilip üretilmediğine bakılmaksızın bakterileri öldüren veya büyümelerini engelleyen herhangi bir ilaca uygulanmaktadır. ⓘ
"Antibiyotik" terimi anti + βιωτικός (biōtikos), "yaşama uygun, canlı", βίωσις (biōsis), "yaşam biçimi" ve βίος (bios), "yaşam" kelimelerinden türemiştir. "Antibakteriyel" terimi Yunanca ἀντί (anti), "karşı" + βακτήριον (baktērion), βακτηρία (baktēria), "asa, baston" kelimesinin küçültülmüş halinden türemiştir, çünkü keşfedilen ilk bakteriler çubuktu. ⓘ
Kullanım
Tıbbi kullanımlar
Antibiyotikler bakteriyel enfeksiyonları ve bazen de protozoan enfeksiyonları tedavi etmek veya önlemek için kullanılır. (Metronidazol bir dizi parazit hastalığına karşı etkilidir). Bir enfeksiyonun bir hastalıktan sorumlu olduğundan şüphelenildiğinde ancak sorumlu patojen tanımlanamadığında, ampirik bir tedavi benimsenir. Bu, sunulan belirti ve semptomlara dayanarak geniş spektrumlu bir antibiyotiğin uygulanmasını içerir ve birkaç gün sürebilen laboratuvar sonuçları beklenirken başlatılır. ⓘ
Sorumlu patojen mikroorganizma zaten bilindiğinde veya tanımlandığında, kesin tedaviye başlanabilir. Bu genellikle dar spektrumlu bir antibiyotik kullanımını içerecektir. Verilecek antibiyotiğin seçimi de maliyetine göre yapılacaktır. Tanımlama, antibiyotik tedavisinin maliyetini ve toksisitesini azaltabileceği ve ayrıca antimikrobiyal direncin ortaya çıkma olasılığını azaltabileceği için kritik öneme sahiptir. Ameliyattan kaçınmak için, komplike olmayan akut apandisit için antibiyotik verilebilir. ⓘ
Antibiyotikler önleyici bir tedbir olarak verilebilir ve bu genellikle bağışıklık sistemi zayıf olanlar (özellikle HIV vakalarında pnömoniyi önlemek için), bağışıklık sistemini baskılayıcı ilaçlar kullananlar, kanser hastaları ve ameliyat olanlar gibi risk altındaki popülasyonlarla sınırlıdır. Cerrahi prosedürlerde kullanımları, insizyonların enfeksiyon kapmasını önlemeye yardımcı olmak içindir. Diş hekimliğinde antibiyotik profilaksisinde önemli bir role sahiptirler ve kullanımları bakteriyemi ve buna bağlı enfektif endokarditi önleyebilir. Antibiyotikler ayrıca özellikle kansere bağlı nötropeni vakalarında enfeksiyonu önlemek için kullanılır. ⓘ
Koroner kalp hastalığının ikincil olarak önlenmesi için antibiyotik kullanımı mevcut bilimsel kanıtlarla desteklenmemektedir ve aslında kardiyovasküler mortaliteyi, tüm nedenlere bağlı mortaliteyi ve inme oluşumunu artırabilir. ⓘ
Uygulama yolları
Antibiyotik tedavisi için birçok farklı uygulama yolu vardır. Antibiyotikler genellikle ağız yoluyla alınır. Daha ciddi vakalarda, özellikle de derin sistemik enfeksiyonlarda, antibiyotikler damardan veya enjeksiyon yoluyla verilebilir. Enfeksiyon bölgesine kolayca erişilebildiği durumlarda, antibiyotikler konjonktivit için konjonktiva üzerine göz damlası veya kulak enfeksiyonları ve akut yüzücü kulağı vakaları için kulak damlası şeklinde topikal olarak verilebilir. Topikal kullanım aynı zamanda akne ve selülit gibi bazı cilt rahatsızlıkları için de tedavi seçeneklerinden biridir. Topikal uygulamanın avantajları arasında enfeksiyon bölgesinde yüksek ve sürekli antibiyotik konsantrasyonu elde edilmesi; sistemik emilim ve toksisite potansiyelinin azaltılması ve gerekli toplam antibiyotik hacimlerinin azaltılması ve böylece antibiyotiklerin yanlış kullanım riskinin azaltılması yer almaktadır. Belirli cerrahi yara türlerinin üzerine uygulanan topikal antibiyotiklerin cerrahi alan enfeksiyonu riskini azalttığı bildirilmiştir. Bununla birlikte, antibiyotiklerin topikal olarak uygulanmasıyla ilgili bazı genel endişe nedenleri vardır. Antibiyotiğin bir miktar sistemik emilimi meydana gelebilir; uygulanan antibiyotik miktarının doğru bir şekilde dozlanması zordur ve ayrıca lokal aşırı duyarlılık reaksiyonları veya kontakt dermatit meydana gelme olasılığı da vardır. Özellikle hayatı tehdit eden enfeksiyonlarda antibiyotiklerin mümkün olan en kısa sürede uygulanması tavsiye edilir. Birçok acil servis bu amaçla antibiyotik stoklamaktadır. ⓘ
Küresel tüketim
Antibiyotik tüketimi ülkeler arasında büyük farklılıklar göstermektedir. DSÖ'nün 2018 yılında yayınladığı "Antibiyotik Tüketiminin Gözetimi" raporunda 65 ülkenin 2015 verileri analiz edilmiştir. Günlük 1.000 kişi başına tanımlanmış günlük doz olarak ölçülmüştür. Moğolistan 64,4'lük bir oranla en yüksek tüketime sahiptir. Burundi ise 4,4 ile en düşük orana sahipti. Amoksisilin ve amoksisilin/klavulanik asit en sık tüketilen ilaçlardır. ⓘ
Yan etkiler

Antibiyotikler klinik kullanım için onaylanmadan önce herhangi bir olumsuz etkiye karşı taranır ve genellikle güvenli ve iyi tolere edildiği kabul edilir. Ancak bazı antibiyotikler, kullanılan antibiyotiğin türüne, hedeflenen mikroplara ve hastaya bağlı olarak hafiften çok şiddetliye kadar değişen geniş bir yelpazede olumsuz yan etkilerle ilişkilendirilmiştir. Yan etkiler antibiyotiğin farmakolojik veya toksikolojik özelliklerini yansıtabilir veya aşırı duyarlılık veya alerjik reaksiyonları içerebilir. Yan etkiler ateş ve mide bulantısından fotodermatit ve anafilaksi dahil olmak üzere büyük alerjik reaksiyonlara kadar değişir. ⓘ
Oral antibiyotiklerin yaygın yan etkileri arasında, bağırsak florasındaki tür kompozisyonunun bozulmasından kaynaklanan ve örneğin Clostridium difficile gibi patojenik bakterilerin aşırı çoğalmasıyla sonuçlanan ishal yer alır. Antibiyotik tedavisi sırasında probiyotik almak antibiyotikle ilişkili ishalin önlenmesine yardımcı olabilir. Antibakteriyeller vajinal florayı da etkileyebilir ve vulvo-vajinal bölgede Candida cinsi maya türlerinin aşırı çoğalmasına yol açabilir. Sistemik kortikosteroid ile birlikte kinolon antibiyotik kullanımından kaynaklanan tendon hasarı olasılığı gibi diğer ilaçlarla etkileşimden kaynaklanan ek yan etkiler ortaya çıkabilir. ⓘ
Bazı antibiyotikler, insan hücreleri de dahil olmak üzere ökaryotik hücrelerde bulunan bakteri türevi bir organel olan mitokondriyona da zarar verebilir. Mitokondriyal hasar hücrelerde oksidatif strese neden olur ve florokinolonların yan etkileri için bir mekanizma olarak önerilmiştir. Ayrıca kloroplastları etkiledikleri de bilinmektedir. ⓘ
Etkileşimler
Doğum kontrol hapları
Antibiyotik kullanımının oral kontraseptif başarısızlığı riskini artırıp artırmadığına dair az sayıda iyi kontrollü çalışma vardır. Çalışmaların çoğu antibiyotiklerin doğum kontrol haplarıyla etkileşime girmediğini göstermektedir, örneğin antibiyotiklerin neden olduğu doğum kontrol haplarının başarısızlık oranının çok düşük olduğunu gösteren klinik çalışmalar (yaklaşık %1). Oral kontraseptif başarısızlığı riskini artırabilecek durumlar arasında uyumsuzluk (hapı almamak), kusma veya ishal sayılabilir. Kandaki etinilestradiol serum seviyelerini etkileyen gastrointestinal bozukluklar veya oral kontraseptif emiliminde hastalar arası değişkenlik. Adet düzensizliği olan kadınlarda başarısızlık riski daha yüksek olabilir ve antibiyotik tedavisi sırasında ve tedavinin tamamlanmasından sonraki bir hafta boyunca yedek kontrasepsiyon kullanmaları önerilmelidir. Oral kontraseptif etkinliğinin azalması için hastaya özgü risk faktörlerinden şüpheleniliyorsa, yedek kontrasepsiyon önerilir. ⓘ
Geniş spektrumlu antibiyotik rifampisin gibi antibiyotiklerin doğum kontrol haplarının etkinliğini etkilediğinin öne sürüldüğü durumlarda, bu vakalar hepatik karaciğer enzimlerinin aktivitelerindeki artışa bağlı olarak hapın aktif bileşenlerinin daha fazla parçalanmasına neden olabilir. Kolonda östrojen emiliminin azalmasına neden olabilecek bağırsak florası üzerindeki etkiler de öne sürülmüştür, ancak bu tür öneriler kesin değildir ve tartışmalıdır. Klinisyenler, oral kontraseptiflerle etkileşime girdiğinden şüphelenilen antibiyotiklerin kullanıldığı tedaviler sırasında ekstra kontraseptif önlemlerin uygulanmasını tavsiye etmişlerdir. Antibiyotikler ve doğum kontrol hapları (oral kontraseptifler) arasındaki olası etkileşimler hakkında daha fazla çalışma yapılmasının yanı sıra, yedek kontrasepsiyon ihtiyacını reddetmeden önce potansiyel oral kontraseptif hap başarısızlığı için hastaya özgü risk faktörlerinin dikkatli bir şekilde değerlendirilmesi gerekmektedir. ⓘ
Alkol
Alkol ve bazı antibiyotikler arasında etkileşimler meydana gelebilir ve yan etkilere ve antibiyotik tedavisinin etkinliğinin azalmasına neden olabilir. Orta düzeyde alkol tüketiminin birçok yaygın antibiyotikle etkileşime girmesi olası olmasa da, alkol tüketiminin ciddi yan etkilere neden olabileceği belirli antibiyotik türleri vardır. Bu nedenle, potansiyel yan etki riskleri ve etkinlik, uygulanan antibiyotiğin türüne bağlıdır. ⓘ
Metronidazol, tinidazol, sefamandol, latamoksef, sefoperazon, sefmenoksim ve furazolidon gibi antibiyotikler, asetaldehit dehidrojenaz tarafından parçalanmasını engelleyerek alkol ile disülfiram benzeri bir kimyasal reaksiyona neden olur ve bu da kusma, mide bulantısı ve nefes darlığı ile sonuçlanabilir. Buna ek olarak, doksisiklin ve eritromisin süksinatın etkinliği alkol tüketimi ile azalabilir. Alkolün antibiyotik aktivitesi üzerindeki diğer etkileri, antibiyotik bileşiğini parçalayan karaciğer enzimlerinin değişen aktivitesini içerir. ⓘ
Farmakodinamik
Antibakteriyel bileşiklerle antimikrobiyal tedavinin başarılı sonucu çeşitli faktörlere bağlıdır. Bunlar arasında konak savunma mekanizmaları, enfeksiyonun yeri ve antibakteriyelin farmakokinetik ve farmakodinamik özellikleri yer almaktadır. Antibakteriyellerin bakterisidal aktivitesi bakteriyel büyüme fazına bağlı olabilir ve genellikle devam eden metabolik aktivite ve bakteri hücrelerinin bölünmesini gerektirir. Bu bulgular laboratuvar çalışmalarına dayanmaktadır ve klinik ortamlarda bakteriyel enfeksiyonu ortadan kaldırdığı da gösterilmiştir. Antibakteriyellerin aktivitesi sıklıkla konsantrasyonuna bağlı olduğundan, antibakteriyel aktivitenin in vitro karakterizasyonu genellikle bir antibakteriyelin minimum inhibitör konsantrasyonunun ve minimum bakterisidal konsantrasyonunun belirlenmesini içerir. Klinik sonucu tahmin etmek için, bir antibakteriyelin antimikrobiyal aktivitesi genellikle farmakokinetik profili ile birleştirilir ve ilaç etkinliğinin belirteçleri olarak çeşitli farmakolojik parametreler kullanılır. ⓘ
Kombinasyon tedavisi
Tüberküloz da dahil olmak üzere önemli enfeksiyon hastalıklarında, kombinasyon tedavisi (yani iki veya daha fazla antibiyotiğin eş zamanlı uygulanması) direncin ortaya çıkmasını geciktirmek veya önlemek için kullanılmıştır. Akut bakteriyel enfeksiyonlarda, kombinasyon tedavisinin bir parçası olan antibiyotikler, her iki antibiyotiğin kombine etkisi bireysel etkilerinden daha iyi olduğundan, tedavi sonuçlarını iyileştirmek için sinerjik etkileri nedeniyle reçete edilir. Metisiline dirençli Staphylococcus aureus enfeksiyonları fusidik asit ve rifampisin kombinasyon tedavisi ile tedavi edilebilir. Kombinasyon halinde kullanılan antibiyotikler de antagonistik olabilir ve iki antibiyotiğin kombine etkileri, antibiyotiklerden birinin monoterapi olarak verilmesinden daha az olabilir. Örneğin, kloramfenikol ve tetrasiklinler penisilinlere karşı antagonisttir. Ancak bu durum bakteri türüne bağlı olarak değişebilir. Genel olarak, bakteriyostatik bir antibiyotik ve bakterisidal antibiyotik kombinasyonları antagonistiktir. ⓘ
Bir antibiyotiğin başka bir antibiyotikle kombine edilmesine ek olarak, antibiyotikler bazen direnç modifiye edici ajanlarla birlikte uygulanır. Örneğin, bir hasta β-laktamaz üreten bir bakteri suşu ile enfekte olduğunda, β-laktam antibiyotikler klavulanik asit veya sulbaktam gibi β-laktamaz inhibitörleri ile birlikte kullanılabilir. ⓘ
Sınıflar


Antibiyotikler genellikle etki mekanizmalarına, kimyasal yapılarına veya aktivite spektrumlarına göre sınıflandırılır. Çoğu bakteriyel fonksiyonları veya büyüme süreçlerini hedef alır. Bakteriyel hücre duvarını (penisilinler ve sefalosporinler) veya hücre zarını (polimiksinler) hedef alan veya temel bakteriyel enzimlere müdahale edenlerin (rifamisinler, lipiarmisinler, kinolonlar ve sülfonamidler) bakterisidal aktiviteleri vardır. Protein sentezi inhibitörleri (makrolidler, linkozamidler ve tetrasiklinler) genellikle bakteriyostatiktir (bakterisidal aminoglikozidler hariç). Diğer sınıflandırmalar hedef spesifikliklerine göre yapılır. "Dar spektrumlu" antibiyotikler gram-negatif veya gram-pozitif gibi belirli bakteri türlerini hedef alırken, geniş spektrumlu antibiyotikler geniş bir bakteri yelpazesini etkiler. Antibakteriyel bileşik sınıflarının keşfedilmesine verilen 40 yıllık aranın ardından, 2000'lerin sonu ve 2010'ların başında dört yeni antibiyotik sınıfı klinik kullanıma sunulmuştur: siklik lipopeptitler (daptomisin gibi), glisilsiklinler (tigesiklin gibi), oksazolidinonlar (linezolid gibi) ve lipiarmisinler (fidaxomicin gibi). ⓘ
Üretim
Tıbbi kimyadaki ilerlemelerle birlikte, modern antibakteriyellerin çoğu çeşitli doğal bileşiklerin yarı sentetik modifikasyonlarıdır. Bunlar arasında örneğin penisilinler (Penicillium cinsi mantarlar tarafından üretilen), sefalosporinler ve karbapenemleri içeren beta-laktam antibiyotikler yer almaktadır. Halen canlı organizmalardan izole edilen bileşikler aminoglikozidler iken, diğer antibakteriyeller - örneğin sülfonamidler, kinolonlar ve oksazolidinonlar - yalnızca kimyasal sentez yoluyla üretilmektedir. Birçok antibakteriyel bileşik, 1000 daltondan daha az moleküler ağırlığa sahip nispeten küçük moleküllerdir. ⓘ
Howard Florey ve Chain'in 1939'daki ilk öncü çabalarından bu yana, antibakteriyeller de dahil olmak üzere antibiyotiklerin tıp için önemi, antibakteriyellerin büyük ölçeklerde üretilmesine yönelik yoğun araştırmalara yol açmıştır. Antibakteriyellerin geniş bir bakteri yelpazesine karşı taranmasının ardından, aktif bileşiklerin üretimi genellikle güçlü aerobik koşullarda fermantasyon kullanılarak gerçekleştirilir. ⓘ
Direnç
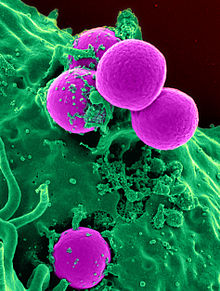
Antibiyotiklere dirençli bakterilerin ortaya çıkması yaygın bir olgudur. Direncin ortaya çıkması genellikle antibiyotik tedavisi sırasında gerçekleşen evrimsel süreçleri yansıtır. Antibiyotik tedavisi, fizyolojik veya genetik olarak yüksek dozda antibiyotiklere dayanma kapasitesi gelişmiş bakteri türlerini seçebilir. Belirli koşullar altında, duyarlı bakterilerin büyümesi ilaç tarafından engellenirken, dirençli bakterilerin tercihli büyümesiyle sonuçlanabilir. Örneğin, daha önceden antibakteriyel direnç genleri edinmiş suşlar için antibakteriyel seçilim 1943 yılında Luria-Delbrück deneyi ile gösterilmiştir. Eskiden birçok bakteri türü ve suşuna karşı yüksek etkinliğe sahip olan penisilin ve eritromisin gibi antibiyotikler, birçok bakteri suşunun direncinin artması nedeniyle daha az etkili hale gelmiştir. ⓘ
Direnç, ilaçlı domuz dışkısı yoluyla sülfametazinle tanışan sülfametazini parçalayan toprak bakterileri gibi farmasötiklerin biyolojik olarak parçalanması şeklinde olabilir. Bakterilerin hayatta kalması genellikle kalıtsal bir dirençten kaynaklanır, ancak antibakteriyellere karşı direncin artması yatay gen transferi yoluyla da gerçekleşir. Yatay aktarımın antibiyotiklerin sık kullanıldığı yerlerde gerçekleşme olasılığı daha yüksektir. ⓘ
Antibakteriyel direnç biyolojik bir maliyet getirebilir, böylece dirençli suşların uygunluğunu azaltabilir, bu da örneğin antibakteriyel bileşiklerin yokluğunda antibakteriyel dirençli bakterilerin yayılmasını sınırlayabilir. Bununla birlikte, ilave mutasyonlar bu uygunluk maliyetini telafi edebilir ve bu bakterilerin hayatta kalmasına yardımcı olabilir. ⓘ
Paleontolojik veriler, hem antibiyotiklerin hem de antibiyotik direncinin eski bileşikler ve mekanizmalar olduğunu göstermektedir. Faydalı antibiyotik hedefleri, mutasyonların bakteriyel üremeyi veya yaşayabilirliği olumsuz etkilediği hedeflerdir. ⓘ
Antibakteriyel direncin çeşitli moleküler mekanizmaları mevcuttur. İçsel antibakteriyel direnç, bakteri suşlarının genetik yapısının bir parçası olabilir. Örneğin, bir antibiyotik hedefi bakteriyel genomda bulunmayabilir. Edinilmiş direnç, bakteri kromozomundaki bir mutasyondan veya ekstra kromozomal DNA'nın edinilmesinden kaynaklanır. Antibakteriyel üreten bakteriler, antibakteriyel dirençli suşlara benzer olduğu ve onlara aktarılmış olabileceği gösterilen direnç mekanizmaları geliştirmiştir. Antibakteriyel direncin yayılması genellikle büyüme sırasında mutasyonların dikey aktarımı ve yatay genetik değişim yoluyla DNA'nın genetik rekombinasyonu yoluyla gerçekleşir. Örneğin, antibakteriyel direnç genleri, bu direnç genlerini taşıyan plazmidler aracılığıyla farklı bakteri suşları veya türleri arasında değiş tokuş edilebilir. Birkaç farklı direnç geni taşıyan plazmidler birden fazla antibakteriyele direnç kazandırabilir. Tek bir gen tarafından kodlanan bir direnç mekanizması birden fazla antibakteriyel bileşiğe direnç sağladığında da çeşitli antibakteriyellere karşı çapraz direnç oluşabilir. ⓘ
Bazen "süper böcekler" olarak adlandırılan antibakteriyel dirençli suşlar ve türler, bir süre için iyi kontrol edilen hastalıkların ortaya çıkmasına katkıda bulunmaktadır. Örneğin, tüberküloza neden olan ve daha önce etkili antibakteriyel tedavilere dirençli olan yeni bakteri türleri, birçok terapötik zorluk oluşturmaktadır. Her yıl dünya çapında yaklaşık yarım milyon yeni çok ilaca dirençli tüberküloz (MDR-TB) vakasının ortaya çıktığı tahmin edilmektedir. Örneğin NDM-1, geniş bir beta-laktam antibakteriyel yelpazesine karşı bakteriyel direnci taşıyan yeni tanımlanmış bir enzimdir. Birleşik Krallık Sağlık Koruma Ajansı "NDM-1 enzimine sahip çoğu izolatın, ciddi enfeksiyonların tedavisinde kullanılan tüm standart intravenöz antibiyotiklere karşı dirençli olduğunu" belirtmiştir. 26 Mayıs 2016'da Amerika Birleşik Devletleri'nde "son savunma hattı" antibiyotiği olan kolistine dirençli bir E. coli "superbug" tespit edilmiştir. ⓘ
Yanlış kullanım

The ICU Book'a göre "Antibiyotiklerin ilk kuralı onları kullanmamaya çalışmak, ikinci kuralı ise çok fazla kullanmamaya çalışmaktır." Uygunsuz antibiyotik tedavisi ve antibiyotiklerin aşırı kullanımı, antibiyotiklere dirençli bakterilerin ortaya çıkmasına katkıda bulunmuştur. Antibiyotiklerin kendi kendine reçete edilmesi yanlış kullanıma bir örnektir. Birçok antibiyotik, antibiyotiklere yanıt vermeyen veya tedavi olmaksızın düzelmesi muhtemel semptomları veya hastalıkları tedavi etmek için sıklıkla reçete edilmektedir. Ayrıca, bazı bakteriyel enfeksiyonlar için yanlış veya optimal olmayan antibiyotikler reçete edilmektedir. Penisilin ve eritromisin gibi antibiyotiklerin aşırı kullanımı, 1950'lerden bu yana ortaya çıkan antibiyotik direnci ile ilişkilendirilmektedir. Hastanelerde yaygın antibiyotik kullanımı, en yaygın antibiyotiklerle tedaviye artık yanıt vermeyen bakteri suşları ve türlerindeki artışla da ilişkilendirilmiştir. ⓘ
Antibiyotiklerin kötüye kullanımının yaygın biçimleri arasında seyahat edenlerde profilaktik antibiyotiklerin aşırı kullanımı ve tıp uzmanlarının hastanın kilosuna ve önceki kullanım geçmişine göre doğru dozda antibiyotik reçetelememesi yer almaktadır. Diğer yanlış kullanım şekilleri arasında reçete edilen antibiyotik kürünün tamamının alınmaması, yanlış dozaj ve uygulama veya yeterli iyileşme için dinlenilmemesi yer almaktadır. Uygunsuz antibiyotik tedavisi, örneğin, soğuk algınlığı gibi viral enfeksiyonları tedavi etmek için reçete edilmeleridir. Solunum yolu enfeksiyonları üzerine yapılan bir çalışmada, "hekimlerin antibiyotik bekleyen hastalara antibiyotik reçete etme olasılığının daha yüksek olduğu" tespit edilmiştir. Hem hekimlere hem de hastalara yönelik çok faktörlü müdahaleler, uygunsuz antibiyotik reçete edilmesini azaltabilir. Özellikle kaynakların kısıtlı olduğu ortamlarda hızlı bakım noktası tanı testlerinin eksikliği, antibiyotiklerin yanlış kullanımının nedenlerinden biri olarak kabul edilmektedir. ⓘ
Antimikrobiyal dirençle ilgilenen çeşitli kuruluşlar, gereksiz antibiyotik kullanımını ortadan kaldırmak için lobi faaliyetleri yürütmektedir. Antibiyotiklerin yanlış ve aşırı kullanımına ilişkin sorunlar, ABD Antimikrobiyal Direnç Kurumlar Arası Görev Gücü'nün oluşturulmasıyla ele alınmıştır. Antimikrobiyal direnci aktif bir şekilde ele almayı amaçlayan bu görev gücü, ABD Hastalık Kontrol ve Önleme Merkezleri, Gıda ve İlaç İdaresi (FDA), Ulusal Sağlık Enstitüleri ve diğer ABD kurumları tarafından koordine edilmektedir. Bir sivil toplum kuruluşu kampanya grubu da Keep Antibiotics Working'dir. Fransa'da 2002 yılında başlatılan "Antibiyotikler otomatik değildir" başlıklı hükümet kampanyası, özellikle çocuklarda gereksiz antibiyotik reçetelerinde belirgin bir azalmaya yol açmıştır. ⓘ
Antibiyotik direncinin ortaya çıkması, 1970 yılında İngiltere'de antibiyotik kullanımına kısıtlamalar getirilmesine neden olmuştur (Swann raporu 1969) ve Avrupa Birliği 2003 yılından bu yana antibiyotiklerin büyümeyi teşvik edici ajanlar olarak kullanılmasını yasaklamıştır. Ayrıca, çeşitli kuruluşlar (Dünya Sağlık Örgütü, Ulusal Bilimler Akademisi ve ABD Gıda ve İlaç İdaresi dahil) gıda hayvanı üretiminde antibiyotik kullanım miktarının kısıtlanmasını savunmuştur. Bununla birlikte, antibiyotik kullanımını sınırlandırmaya yönelik düzenleyici ve yasama faaliyetlerinde genellikle gecikmeler yaşanmaktadır; bu gecikmeler kısmen antibiyotik kullanan veya satan endüstrilerin bu tür düzenlemelere karşı direnç göstermesinden ve antibiyotik kullanımı ile antibiyotiklere karşı direnç arasındaki nedensel bağlantıları test etmek için gerekli araştırmaların zaman almasından kaynaklanmaktadır. ABD gıda hayvanlarında antibiyotiklerin tedavi amaçlı olmayan kullanımını aşamalı olarak durdurmayı amaçlayan iki federal yasa tasarısı (S.742 ve H.R. 2562) önerilmiş ancak kabul edilmemiştir. Bu yasa tasarıları, aralarında Amerikan Bütünsel Hemşireler Derneği, Amerikan Tıp Derneği ve Amerikan Halk Sağlığı Derneği'nin de bulunduğu halk sağlığı ve tıp örgütleri tarafından desteklenmiştir. ⓘ
Gıda şirketleri ve restoranların antibiyotiklerle tedavi edilen hayvanlardan elde edilen etleri azaltma veya ortadan kaldırma taahhütlerine rağmen, çiftlik hayvanlarında kullanılmak üzere antibiyotik alımı her yıl artmaktadır. ⓘ
Antibiyotiklerin hayvancılıkta yaygın kullanımı söz konusudur. Amerika Birleşik Devletleri'nde, çiftlik hayvanlarında antibiyotik kullanımına bağlı olarak antibiyotiklere dirençli bakteri türlerinin ortaya çıkması sorunu 1977 yılında ABD Gıda ve İlaç Dairesi (FDA) tarafından gündeme getirilmiştir. Mart 2012'de, Amerika Birleşik Devletleri New York Güney Bölgesi Bölge Mahkemesi, Doğal Kaynakları Savunma Konseyi ve diğerleri tarafından açılan bir davada karar vererek, FDA'nın çiftlik hayvanlarında FDA düzenlemelerini ihlal eden antibiyotik kullanım onaylarını iptal etmesine hükmetmiştir. ⓘ
Araştırmalar, yaygın hafif hastalıkları tedavi etmek için antibiyotiklerin etkinliği ve gerekliliği hakkındaki yaygın yanlış kanıların, aşırı kullanımlarına katkıda bulunduğunu göstermiştir. ⓘ
Tarihçe
20. yüzyılın başlarından önce enfeksiyonlara yönelik tedaviler öncelikle tıbbi folklora dayanıyordu. Enfeksiyonların tedavisinde kullanılan antimikrobiyal özelliklere sahip karışımlar 2.000 yıl önce tanımlanmıştır. Eski Mısırlılar ve eski Yunanlılar da dahil olmak üzere birçok eski kültür, enfeksiyonları tedavi etmek için özel olarak seçilmiş küf ve bitki materyalleri kullanmıştır. 1990'larda incelenen Nubya mumyalarının önemli düzeyde tetrasiklin içerdiği bulunmuştur. Kaynağın o dönemde üretilen bira olduğu tahmin ediliyor. ⓘ
Antibiyotiklerin modern tıpta kullanımı, boyalardan elde edilen sentetik antibiyotiklerin keşfedilmesiyle başlamıştır. ⓘ
Boyalardan elde edilen sentetik antibiyotikler

Sentetik antibiyotik kemoterapisi bir bilim dalı olarak ve antibakteriyellerin geliştirilmesi 1880'lerin sonunda Paul Ehrlich ile Almanya'da başlamıştır. Ehrlich, bazı boyaların insan, hayvan veya bakteri hücrelerini renklendirdiğini, diğerlerinin ise renklendirmediğini fark etti. Daha sonra, insan konakçıya zarar vermeden bakterilere bağlanacak ve onları öldürecek seçici bir ilaç görevi görecek kimyasallar yaratmanın mümkün olabileceği fikrini ortaya attı. Çeşitli organizmalara karşı yüzlerce boyayı taradıktan sonra, 1907'de tıbbi açıdan yararlı bir ilaç keşfetti; günümüzde arsphenamine olarak adlandırılan ilk sentetik antibakteriyel organoarsenik bileşik salvarsan. ⓘ

Bu, 1907 yılında Alfred Bertheim ve Ehrlich tarafından bir dizi arsenik türevi sentetik antibiyotiğin keşfedilmesiyle başlayan antibakteriyel tedavi çağının habercisiydi. Ehrlich ve Bertheim, farelerde tripanosomiasis ve tavşanlarda spirochaeta enfeksiyonunu tedavi etmek için boyalardan elde edilen çeşitli kimyasallarla deneyler yapmıştı. İlk bileşikleri çok toksik olsa da, Ehrlich ve frengiyi tedavi edecek bir ilaç arayışında Erlich ile birlikte çalışan bir Japon bakteriyolog olan Sahachiro Hata, deney serilerindeki 606. bileşikle başarıya ulaştılar. 1910 yılında Ehrlich ve Hata, "606" ilacı adını verdikleri keşiflerini Wiesbaden'deki İç Hastalıkları Kongresi'nde duyurdular. Hoechst şirketi, 1910 yılının sonlarına doğru bileşiği Salvarsan adı altında pazarlamaya başladı, şimdi arsphenamine olarak biliniyor. İlaç 20. yüzyılın ilk yarısında sifiliz tedavisinde kullanıldı. 1908 yılında Ehrlich, immünolojiye yaptığı katkılardan dolayı Nobel Fizyoloji veya Tıp Ödülü'nü aldı. Hata 1911 yılında Nobel Kimya Ödülü'ne, 1912 ve 1913 yıllarında ise Nobel Fizyoloji veya Tıp Ödülü'ne aday gösterilmiştir. ⓘ
İlk sülfonamid ve sistemik olarak aktif ilk antibakteriyel ilaç olan Prontosil, Gerhard Domagk liderliğindeki bir araştırma ekibi tarafından 1932 veya 1933'te Almanya'daki IG Farben holdingine bağlı Bayer Laboratuvarlarında geliştirildi ve Domagk 1939 Nobel Fizyoloji veya Tıp Ödülü'nü aldı. Prontosil'in aktif ilacı olan sülfanilamid, boya endüstrisinde birkaç yıldır kullanılmakta olduğu için patentlenebilir değildi. Prontosil, Gram-pozitif koklara karşı nispeten geniş bir etkiye sahipti, ancak enterobakterilere karşı etkili değildi. Başarısı araştırmaları hızla teşvik etti. Bu sülfonamid ilacın keşfi ve geliştirilmesi antibakteriyeller çağını açtı. ⓘ
Penisilin ve diğer doğal antibiyotikler
Bazı mikroorganizmaların diğer mikroorganizmaların büyümesini engellediğine dair gözlemler 19. yüzyılın sonlarından beri rapor edilmektedir. Mikroorganizmalar arasındaki bu antibiyoz gözlemleri doğal antibakteriyellerin keşfine yol açmıştır. Louis Pasteur, "bazı bakteriler arasında gözlemlenen antagonizmaya müdahale edebilseydik, bu belki de tedavi için en büyük umutları sunacaktı" gözleminde bulunmuştur. ⓘ
1874 yılında doktor Sir William Roberts, bazı mavi peynir türlerinin yapımında kullanılan Penicillium glaucum küfü kültürlerinin bakteri kontaminasyonu göstermediğini kaydetti. 1876 yılında fizikçi John Tyndall da bu alana katkıda bulunmuştur. ⓘ
1895 yılında İtalyan doktor Vincenzo Tiberio, bazı küf özütlerinin antibakteriyel gücü üzerine bir makale yayınladı. ⓘ
1897'de doktora öğrencisi Ernest Duchesne "Contribution à l'étude de la concurrence vitale chez les micro-organismes: antagonisme entre les moisissures et les microbes" (Mikro organizmalarda yaşamsal rekabetin incelenmesine katkı: küfler ve mikroplar arasındaki antagonizm) başlıklı bir tez sunmuştur; bu, küflerin anti-mikrobiyal aktivitelerinden kaynaklanan tedavi edici yeteneklerini ele alan bilinen ilk bilimsel çalışmadır. Duchesne tezinde, bakteri ve küflerin hayatta kalmak için sürekli bir savaşa girdiğini öne sürmüştür. Duchesne, her ikisi de aynı kültürde yetiştirildiğinde E. coli'nin Penicillium glaucum tarafından ortadan kaldırıldığını gözlemledi. Ayrıca laboratuvar hayvanlarına Penicillium glaucum ile birlikte ölümcül dozlarda tifo basili aşıladığında hayvanların tifoya yakalanmadığını gözlemlemiştir. Ne yazık ki Duchesne'in diplomasını aldıktan sonra askere gitmesi daha fazla araştırma yapmasını engelledi. Duchesne, artık antibiyotiklerle tedavi edilen bir hastalık olan tüberkülozdan öldü. ⓘ
1928 yılında Sir Alexander Fleming, bazı küfler tarafından üretilen ve bazı bakteri türlerini öldüren ya da büyümesini durduran bir molekül olan penisilinin varlığını öne sürdü. Fleming, kültür plakalarından birinde yeşil bir küf olan Penicillium rubens'in sporlarını fark ettiğinde, hastalığa neden olan bir bakteri kültürü üzerinde çalışıyordu. Küfün varlığının bakterileri öldürdüğünü ya da büyümelerini engellediğini gözlemledi. Fleming, küfün antibakteriyel bir madde salgılaması gerektiğini varsaydı ve 1928'de bu maddeye penisilin adını verdi. Fleming, antibakteriyel özelliklerinden kemoterapi için yararlanılabileceğine inanıyordu. Başlangıçta bazı biyolojik özelliklerini karakterize etti ve bazı enfeksiyonları tedavi etmek için ham bir preparat kullanmaya çalıştı, ancak eğitimli kimyagerlerin yardımı olmadan daha fazla geliştirmeyi sürdüremedi. ⓘ
Ernst Chain, Howard Florey ve Edward Abraham 1942'de ilk penisilin olan penisilin G'yi saflaştırmayı başardılar, ancak 1945'ten önce Müttefik ordusu dışında yaygın olarak kullanılamadı. Daha sonra Norman Heatley, penisilini toplu halde verimli bir şekilde saflaştırmak için geri ekstraksiyon tekniğini geliştirdi. Penisilinin kimyasal yapısı ilk olarak 1942 yılında Abraham tarafından önerilmiş ve daha sonra 1945 yılında Dorothy Crowfoot Hodgkin tarafından doğrulanmıştır. Saflaştırılmış penisilin çok çeşitli bakterilere karşı güçlü antibakteriyel aktivite göstermiş ve insanlarda düşük toksisiteye sahip olmuştur. Ayrıca, sentetik sülfonamidlerin aksine, aktivitesi irin gibi biyolojik bileşenler tarafından inhibe edilmemiştir. (aşağıya bakınız) Penisilinin geliştirilmesi, benzer etkinlik ve güvenliğe sahip antibiyotik bileşiklerinin araştırılmasına yönelik ilginin yenilenmesine yol açmıştır. Chain ve Florey, Fleming'in tesadüfen keşfettiği ancak kendisinin geliştiremediği penisilini tedavi edici bir ilaç olarak başarılı bir şekilde geliştirdikleri için 1945 Nobel Tıp Ödülünü Fleming ile paylaştılar. ⓘ
Florey, René Dubos'u, gramisidinin keşfine yol açan ve Florey'in penisilin araştırmalarını canlandıran antibakteriyel bileşiklerin kasıtlı ve sistematik olarak araştırılması yaklaşımına öncülük ettiği için takdir etti. İkinci Dünya Savaşı'nın başladığı 1939 yılında Dubos, Bacillus brevis'ten %20 gramisidin ve %80 tirosidin bileşimi olan ilk doğal kaynaklı antibiyotik olan tirotrisinin keşfini rapor etmiştir. Ticari olarak üretilen ilk antibiyotiklerden biriydi ve İkinci Dünya Savaşı sırasında yaraların ve ülserlerin tedavisinde çok etkili oldu. Ancak gramisidin toksisite nedeniyle sistemik olarak kullanılamıyordu. Tyrocidine'in de sistemik kullanım için çok toksik olduğu kanıtlanmıştır. Bu dönemde elde edilen araştırma sonuçları İkinci Dünya Savaşı sırasında Mihver ve Müttefik güçler arasında paylaşılmamış ve Soğuk Savaş sırasında sınırlı erişim sağlanmıştır. ⓘ
20. yüzyılın sonları
20. yüzyılın ortalarında, tıbbi kullanım için sunulan yeni antibiyotik maddelerin sayısı önemli ölçüde artmıştır. 1935'ten 1968'e kadar 12 yeni sınıf piyasaya sürülmüştür. Ancak bu tarihten sonra yeni sınıfların sayısı belirgin bir şekilde düşmüş ve 1969 ile 2003 yılları arasında sadece iki yeni sınıf piyasaya sürülmüştür. ⓘ
Antibiyotik boru hattı
Hem DSÖ hem de Amerika Bulaşıcı Hastalıklar Derneği, zayıf antibiyotik hattının bakterilerin artan direnç geliştirme kabiliyetiyle uyuşmadığını bildirmektedir. Amerika Bulaşıcı Hastalıklar Derneği'nin raporunda, her yıl piyasaya sürülmek üzere onaylanan yeni antibiyotiklerin sayısının azaldığı belirtilmiş ve Gram-negatif basillere karşı şu anda faz 2 veya faz 3 klinik çalışmalarda olan yedi antibiyotik tespit edilmiştir. Ancak bu ilaçlar Gram-negatif basillerin direnç spektrumunun tamamına hitap etmemektedir. DSÖ'ye göre Mayıs 2017 itibariyle elli bir yeni terapötik varlık - antibiyotikler (kombinasyonlar dahil), faz 1-3 klinik çalışmalarda yer almaktadır. Çoklu ilaca dirençli Gram-pozitif patojenleri hedef alan antibiyotikler yüksek bir öncelik olmaya devam etmektedir. ⓘ
Son yedi yılda birkaç antibiyotik pazarlama izni almıştır. Sefalosporin seftarolin ve lipoglikopeptidler oritavancin ve telavancin akut bakteriyel deri ve deri yapısı enfeksiyonu ve toplum kökenli bakteriyel pnömoni tedavisi için. Lipoglikopeptid dalbavansin ve oksazolidinon tedizolid de akut bakteriyel deri ve deri yapısı enfeksiyonu tedavisinde kullanım için onaylanmıştır. Yeni bir dar spektrumlu makrosiklik antibiyotik sınıfının ilki olan fidaxomicin, C. difficile kolitinin tedavisi için onaylanmıştır. Komplike idrar yolu enfeksiyonu ve karın içi enfeksiyon için seftazidim-avibaktam ve seftolozan-avibaktam gibi yeni sefalosporin-laktamaz inhibitörü kombinasyonları da onaylanmıştır. ⓘ
- Seftolozan/tazobaktam (CXA-201; CXA-101/tazobaktam): Antipseudomonal sefalosporin/β-laktamaz inhibitörü kombinasyonu (hücre duvarı sentez inhibitörü). FDA 19 Aralık 2014 tarihinde onaylamıştır.
- Ceftazidime/avibactam (ceftazidime/NXL104): antipseudomonal sefalosporin/β-laktamaz inhibitörü kombinasyonu (hücre duvarı sentez inhibitörü). FDA 25 Şubat 2015 tarihinde onaylamıştır.
- Ceftaroline/avibactam (CPT-avibactam; ceftaroline/NXL104): Anti-MRSA sefalosporin/ β-laktamaz inhibitörü kombinasyonu (hücre duvarı sentez inhibitörü).
- Cefiderocol: sefalosporin siderofor. FDA 14 Kasım 2019 tarihinde onaylamıştır.
- Imipenem/relebactam: karbapenem/ β-laktamaz inhibitörü kombinasyonu (hücre duvarı sentez inhibitörü). FDA 16 Temmuz 2019 tarihinde onaylamıştır.
- Meropenem/vaborbaktam: karbapenem/ β-laktamaz inhibitörü kombinasyonu (hücre duvarı sentezi inhibitörü). FDA 29 Ağustos 2017 tarihinde onaylamıştır.
- Delafloksasin: kinolon (DNA sentezi inhibitörü). FDA 19 Haziran 2017 tarihinde onaylamıştır.
- Plazomisin (ACHN-490): yarı sentetik aminoglikozid türevi (protein sentezi inhibitörü). FDA 25 Haziran 2018 tarihinde onaylamıştır.
- Eravasiklin (TP-434): sentetik tetrasiklin türevi (bakteriyel ribozomları hedefleyen protein sentezi inhibitörü). FDA 27 Ağustos 2018 tarihinde onaylamıştır.
- Omadasiklin: yarı sentetik tetrasiklin türevi (bakteriyel ribozomları hedefleyen protein sentezi inhibitörü). FDA 2 Ekim 2018 tarihinde onaylamıştır.
- Lefamulin: pleuromutilin antibiyotik. FDA 19 Ağustos 2019 tarihinde onaylamıştır.
- Brilacidin (PMX-30063): peptid savunma proteini taklidi (hücre zarı bozulması). Faz 2 aşamasındadır. ⓘ
Olası iyileştirmeler arasında FDA tarafından klinik araştırma düzenlemelerinin netleştirilmesi yer almaktadır. Ayrıca, uygun ekonomik teşvikler ilaç şirketlerini bu çabaya yatırım yapmaya ikna edebilir. ABD'de Hasta Tedavisini İlerletmek için Antibiyotik Geliştirme (ADAPT) Yasası, artan 'süper böcek' tehdidiyle mücadele etmek için antibiyotiklerin ilaç geliştirmesini hızlı bir şekilde takip etmek amacıyla çıkarılmıştır. Bu yasa kapsamında FDA, hayatı tehdit eden enfeksiyonları tedavi eden antibiyotik ve antifungalleri daha küçük klinik deneylere dayanarak onaylayabilmektedir. CDC, antibiyotik kullanımını ve ortaya çıkan direnci izleyecek ve verileri yayınlayacaktır. FDA antibiyotik etiketleme süreci, 'Mikrobiyal Organizmalar için Duyarlılık Testi Yorumlama Kriterleri' veya 'kırılma noktaları', sağlık çalışanlarına doğru veriler sağlayacaktır. The Pew Charitable Trusts sağlık programları kıdemli direktörü Allan Coukell'e göre, "İlaç geliştiricilerinin daha küçük veri setlerine güvenmesine izin vererek ve FDA'nın risk/fayda hesaplaması yaparken bu ilaçlar için daha yüksek düzeyde belirsizliği tolere etme yetkisini netleştirerek, ADAPT klinik deneyleri daha uygulanabilir hale getirecektir." ⓘ
Antibiyotik boru hattının yenilenmesi ve diğer yeni tedavilerin geliştirilmesi
Antibiyotiklere dirençli bakteri türlerinin ortaya çıkmaya ve yayılmaya devam etmesi nedeniyle, yeni antibakteriyel tedavilerin geliştirilmesine sürekli ihtiyaç duyulmaktadır. Mevcut stratejiler arasında doğal ürün bazlı ilaç keşfi gibi geleneksel kimya bazlı yaklaşımlar, ilaç tasarımı gibi daha yeni kimya bazlı yaklaşımlar, immünoglobulin tedavisi gibi geleneksel biyoloji bazlı yaklaşımlar ve faj tedavisi, fekal mikrobiyota nakilleri, antisens RNA bazlı tedaviler ve CRISPR-Cas9 bazlı tedaviler gibi deneysel biyoloji bazlı yaklaşımlar yer almaktadır. ⓘ
Doğal ürün bazlı antibiyotik keşfi
Mevcut kullanımdaki antibiyotiklerin çoğu doğal ürünler veya doğal ürün türevleridir ve yeni antibiyotik arayışında bakteri, mantar, bitki ve hayvan özleri taranmaktadır. Organizmalar test için ekolojik, etnomedikal, genomik veya tarihsel gerekçelere dayalı olarak seçilebilir. Örneğin şifalı bitkiler, geleneksel şifacılar tarafından enfeksiyonu önlemek veya iyileştirmek için kullanıldıkları ve bu nedenle antibakteriyel bileşikler içerebilecekleri temelinde taranmaktadır. Ayrıca, toprak bakterileri, tarihsel olarak çok zengin bir antibiyotik kaynağı oldukları (mevcut kullanımdaki antibiyotiklerin %70 ila 80'i aktinomisetlerden elde edilmektedir) temelinde taranmaktadır. ⓘ
Doğal ürünlerin doğrudan antibakteriyel aktivite açısından taranmasının yanı sıra, bazen antibiyotik direncini ve antibiyotik toleransını bastırma kabiliyetleri açısından da taranırlar. Örneğin, bazı ikincil metabolitler ilaç akış pompalarını inhibe eder, böylece hücresel hedefine ulaşabilen antibiyotik konsantrasyonunu artırır ve antibiyotiğe karşı bakteriyel direnci azaltır. Bakteriyel efluks pompalarını inhibe ettiği bilinen doğal ürünler arasında alkaloid lizergol, karotenoidler kapsantin ve kapsorubin ile flavonoidler rotenon ve krizin bulunmaktadır. Diğer doğal ürünlerin, bu kez ikincil metabolitler yerine birincil metabolitlerin, antibiyotik toleransını ortadan kaldırdığı gösterilmiştir. Örneğin, glikoz, mannitol ve fruktoz Escherichia coli ve Staphylococcus aureus'ta antibiyotik toleransını azaltarak onları aminoglikozid antibiyotikler tarafından öldürülmeye daha duyarlı hale getirmektedir. ⓘ
Doğal ürünler, bakteriyel virülans faktörlerini baskılama kabiliyeti açısından da taranabilir. Virülans faktörleri, bakterilerin vücudun bağışıklık savunmasından kaçmasını (örn. üreaz, stafiloksantin), insan hücrelerine doğru hareket etmesini, yapışmasını ve/veya istila etmesini (örn. tip IV pili, adhezinler, internalinler), virülans genlerinin aktivasyonunu koordine etmesini (örn. quorum sensing) ve hastalığa neden olmasını (örn. ekzotoksinler) sağlayan moleküller, hücresel yapılar ve düzenleyici sistemlerdir. Antivirülans aktivitesine sahip doğal ürünlere örnek olarak flavonoid epigallokateşin gallat (listeriolizin O'yu inhibe eder), kinon tetrangomisin (stafiloksantini inhibe eder) ve seskiterpen zerumbon (Acinetobacter baumannii motilitesini inhibe eder) verilebilir. ⓘ
İmmünoglobulin tedavisi
Antikorlar (anti-tetanoz immünoglobulin) 1910'lardan beri tetanozun tedavisinde ve önlenmesinde kullanılmaktadır ve bu yaklaşım bakteriyel hastalıkların kontrolünde faydalı bir yol olmaya devam etmektedir. Örneğin monoklonal antikor bezlotoxumab, tekrarlayan Clostridium difficile enfeksiyonu için ABD FDA ve EMA tarafından onaylanmıştır ve diğer monoklonal antikorlar geliştirilmektedir (örneğin S. aureus ventilatör ilişkili pnömoninin ek tedavisi için AR-301). Antikor tedavileri, bakteriyel ekzotoksinlere ve diğer virülans faktörlerine bağlanarak ve bunları nötralize ederek etki gösterir. ⓘ
Faj tedavisi

Faj terapisi, antibiyotiğe dirençli bakteri türlerini tedavi etmek için bir yöntem olarak araştırılmaktadır. Faj terapisi, bakteriyel patojenlerin virüslerle enfekte edilmesini içerir. Bakteriyofajlar ve konakçı aralıkları belirli bakteriler için son derece spesifiktir, bu nedenle antibiyotiklerin aksine konakçı organizmanın bağırsak mikrobiyotasını bozmazlar. Basitçe faj olarak da bilinen bakteriyofajlar, öncelikle litik döngüler sırasında bakterileri enfekte eder ve öldürür. Fajlar DNA'larını bakteriye yerleştirir, burada kopyalanır ve yeni fajlar yapmak için kullanılır, ardından hücre parçalanır ve aynı türden başka bakterileri enfekte edip yok edebilecek yeni fajlar serbest kalır. Fajın yüksek özgüllüğü "iyi" bakterileri yok edilmekten korur. ⓘ
Ancak bakteriyofajların kullanımında bazı dezavantajlar da mevcuttur. Bakteriyofajlar genomlarında virülans faktörleri veya toksik genler barındırabilir ve kullanımdan önce genomik dizileme yoluyla bilinen virülans faktörleri veya toksinlerle benzerlik gösteren genlerin tanımlanması ihtiyatlı olabilir. Buna ek olarak, bakteriyel enfeksiyonların ortadan kaldırılması için fajların oral ve IV uygulaması, topikal uygulamadan çok daha yüksek bir güvenlik riski oluşturmaktadır. Ayrıca, bu büyük antijenik kokteyllere karşı belirsiz bağışıklık tepkileri de ek bir endişe kaynağıdır. ⓘ
Bu tür tedaviler için aşılması gereken önemli düzenleyici engeller vardır. Çok sayıda zorluğa rağmen, geleneksel antibiyotiklere artık yanıt vermeyen MDR patojenlere karşı antimikrobiyal ajanların yerine bakteriyofajların kullanılması cazip bir seçenek olmaya devam etmektedir. ⓘ
Fekal mikrobiyota nakli

Fekal mikrobiyota nakilleri, sağlıklı bir insan donörden (dışkı şeklinde) tüm bağırsak mikrobiyotasının C. difficile enfeksiyonu olan hastalara aktarılmasını içerir. Bu prosedür ABD FDA tarafından resmi olarak onaylanmamış olsa da, antibiyotiğe dirençli C. difficile enfeksiyonu olan hastalarda bazı koşullar altında kullanımına izin verilmektedir. Tedavi oranları %90 civarındadır ve dışkı bankaları, standartlaştırılmış ürünler ve oral uygulama yöntemleri geliştirmek için çalışmalar devam etmektedir. ⓘ
Antisens RNA tabanlı tedaviler
Antisens RNA tabanlı tedavi (gen susturma tedavisi olarak da bilinir) (a) temel proteinleri kodlayan bakteriyel genlerin belirlenmesini (örneğin Pseudomonas aeruginosa genleri acpP, lpxC ve rpsJ), (b) bu temel proteinleri kodlayan mRNA'ya tamamlayıcı olan tek sarmallı RNA'nın sentezlenmesini ve (c) tek sarmallı RNA'nın hücreye nüfuz eden peptitler veya lipozomlar kullanılarak enfeksiyon bölgesine iletilmesini içerir. Antisens RNA daha sonra bakteriyel mRNA ile hibridize olur ve temel proteine çevrilmesini engeller. Antisens RNA bazlı tedavinin P. aeruginosa pnömonisinin in vivo modellerinde etkili olduğu gösterilmiştir. ⓘ
Antisens RNA, temel bakteriyel genleri susturmanın yanı sıra antibiyotik direncinden sorumlu bakteriyel genleri susturmak için de kullanılabilir. Örneğin, S. aureus mecA genini (modifiye penisilin bağlayıcı protein 2a'yı kodlayan ve S. aureus suşlarını metisiline dirençli hale getiren gen) susturan antisens RNA geliştirilmiştir. mecA mRNA'yı hedefleyen antisens RNA'nın hem in vitro hem de in vivo çalışmalarda metisiline dirençli stafilokokların oksasiline duyarlılığını geri kazandırdığı gösterilmiştir. ⓘ
CRISPR-Cas9 tabanlı tedaviler
2000'li yılların başında, bakterilerin kendilerini istilacı virüslere karşı savunmalarını sağlayan bir sistem keşfedildi. CRISPR-Cas9 olarak bilinen sistem (a) DNA'yı yok eden bir enzim (nükleaz Cas9) ve (b) daha önce karşılaşılan viral istilacıların DNA dizilerinden (CRISPR) oluşmaktadır. Bu viral DNA dizileri, nükleazın kendi (bakteriyel) DNA'sı yerine yabancı (viral) DNA'yı hedef almasını sağlar. ⓘ
CRISPR-Cas9'un doğadaki işlevi bakterileri korumak olsa da, sistemin CRISPR bileşenindeki DNA dizileri, Cas9 nükleazının viral genler yerine bakteriyel direnç genlerini veya bakteriyel virülans genlerini hedef alacak şekilde değiştirilebilir. Modifiye edilmiş CRISPR-Cas9 sistemi daha sonra plazmidler veya bakteriyofajlar kullanılarak bakteriyel patojenlere uygulanabilir. Bu yaklaşım, in vivo bir enfeksiyon modelinde antibiyotik direncini susturmak ve enterohemorajik E. coli'nin virülansını azaltmak için başarıyla kullanılmıştır. ⓘ
Antibiyotik direnci için seçilim baskısının azaltılması

Yeni antibakteriyel tedaviler geliştirmenin yanı sıra, antibiyotik direncinin ortaya çıkması ve yayılması için seçilim baskısını azaltmak da önemlidir. Bunu gerçekleştirmeye yönelik stratejiler arasında altyapının iyileştirilmesi (örneğin daha az kalabalık konutlar), daha iyi sanitasyon (örneğin güvenli içme suyu ve gıda) ve aşı geliştirme gibi köklü enfeksiyon kontrol önlemleri, antibiyotik yönetimi gibi diğer yaklaşımlar ve enfeksiyonu önlemek için prebiyotik ve probiyotik kullanımı gibi deneysel yaklaşımlar yer almaktadır. Mikrobik hastalıkları tedavi etmek için antibiyotiklerin klinisyenler tarafından değiştirildiği antibiyotik döngüsü önerilmiştir, ancak son çalışmalar bu tür stratejilerin antibiyotik direncine karşı etkisiz olduğunu ortaya koymuştur. ⓘ
Aşılar
Aşılar immün modülasyona veya güçlendirmeye dayanır. Aşılama, makrofajların aktivasyonuna, antikor üretimine, enflamasyona ve diğer klasik bağışıklık reaksiyonlarına yol açarak enfeksiyonu önlemek için bir konağın bağışıklık yeterliliğini ya uyarır ya da güçlendirir. Antibakteriyel aşılar, küresel bakteriyel hastalıklarda ciddi bir azalmadan sorumlu olmuştur. Zayıflatılmış tam hücrelerden veya lizatlardan yapılan aşıların yerini büyük ölçüde, kapsüler polisakkaritler ve bunların konjugatları da dahil olmak üzere saflaştırılmış bileşenlerden protein taşıyıcılarına ve ayrıca inaktive edilmiş toksinler (toksoidler) ve proteinlerden oluşan daha az reaktojenik, hücresiz aşılar almıştır. ⓘ
Etkileri
Antibiyotiklerin iki çeşidi vardır; biyosidal, mikroorganizmaları öldüren antibiyotikler ve biyostatik, mikroorganizmaların büyümesini ve çoğalmasını (üremesini) önleyen antibiyotikler. Her ne kadar "sadece" mikroorganizmaların (çoğunlukla bakteriler, ve bazı Fungi) ürettiklerine "antibiyotik" tanımı verilebilse de, bugün "antibiyotik" terimi patojenlere zarar veren her türlü kimyasal için kullanılmaya başlanmıştır. Bu yüzden, mikroorganizmalar, hayvanlar ve bitkiler tarafından doğal olarak üretilen bu tür kimyasallara "antibiyotik" demekteyiz. Aynı zamanda, doğal olarak üretilen birçok antibiyotik madde sûni yollardan daha etkili olmaları için modifiye edilmektedir. Örnek vermek gerekirse, doğal olarak üretilen penisilinler bugün kimyasal olarak modifiye edilerek daha etkili olmaları sağlanıyor. Bir başka örnekte, kloramfenikol isimli antibiyotiktir. Eskiden tamamıyla doğal yollardan elde edilen bu antibiyotik bugün tamamıyla sentetiktir. ⓘ
Etki mekanizmaları
Antibiyotikler etkili oldukları mikropların metabolik işlemlerine müdahale ederek çalışırlar. Antibiyotikler müdahale ettikleri metabolik işlemlere göre spesifiktir. Bu metabolik işlemlere örnek olarak; protein sentezi, hücre çeperi sentezi, nükleik asit sentezi veya hücre zarı fonksiyonlarını verebiliriz. ⓘ
Penisilin, vankomisin, florokinolon ve sefalosporin gibi antibiyotikler bugün en çok kullanılan antibiyotiklerdendir. Bu antibiyotiklerin hepsi bakterilerin hücre çeperlerini zayıflatırlar. Bakterilerin hücre çeperleri uzun peptidoglikan zincirlerinden oluşur. Antibiyotikler bu molekülleri bir arada tutan peptit bağlantılarının sentezini önlerler. Böylece hücre çeperleri zayıflar ve bakteri patlar (lizis). Peptidoglikandan oluşan hücre çeperleri sadece bakterilerde bulunur, hayvan hücre çeperi bulunmazken bitki hücrelerinde selülozdan oluşan hücre çeperleri bulunur. Böylece, antibiyotikler sadece bakterilere zarar verirler. ⓘ

Streptomisin, eritromisin, tetrasiklin ve kloramfenikol, linezolid, diritromisin gibi antibiyotikler ise ya protein sentezini önlerler ya da anormal proteinlerin sentezlenmesine yol açarlar. Antibiyotikler bunları bakterilerin ribozomlarına -daha doğrusu ribozomal RNA'nın alt birimlerine bağlanmak suretiyle- bağlanarak yaparlar. Bakteri ribozomları ökaryotik ribozomlardan (insan ribozomları gibi) daha küçük oldukları için, bu tür antibiyotikler sadece bakterileri etkiler. Böylece bakterilerin saldırdığı canlıya zarar vermezler. ⓘ
Rifampisin ve antrasiklin gibi antibiyotikler ise nükleik asit sentezine müdahale ederler. Antrasiklinler bunu DNA replikasyonunu önleyerek yaparken, rifampisin bakteriyel transkripsiyonu önler. ⓘ
Bazı antibiyotikler ise patojenleri hücre zarlarına müdahale ederek yok ederler. Hücre zarına yapılan müdahaleler, hücre zarının yapısını değiştirerek onun birçok özelliğini de kaybetmesine yol açar. Bu hücre sitoplazmasının hücre dışına akması gibi hücrenin yıkımıyla sonuçlanacak olaylara yol açabilir. ⓘ
Seçicilik - Selektivite
Bugün, bakteriyel hastalıklarla savaşmakta kullanılan antibiyotikler selektif yani seçicidirler. Buna karşın doğada seçici olmayan birçok antibiyotik de bulunur. Seçici antibiyotikler, işleyişleri (mekanizmaları) dolayısıyla sadece bakteri (mikrop) hücrelerine zarar veren antibiyotiklerdir. Yukarıda verilen antibiyotik tiplerinin hepsi seçicidir. Seçici olmayan antibiyotikler ise mikroba zarar verirken, mesela, insanın vücut hücrelerine de zarar verebilirler. Aynı zamanda antibiyotiklerin yan etkileri de olabilir, bir hastalığı iyileştirirken başka sorunlara yol açabilirler. ⓘ




